トリーメク配合錠の添付文書
- 商品名:
- トリーメク配合錠
- 一般名:
- ドルテグラビル+アバカビル+ラミブジン(DTG/ABC/3TC)
- 略称 :
- TRI

添付文書の読み方
ここで提供している添付文書情報は、2025年2月現在の各医薬品の添付文書を基に作成したものです。書式等については、実際の添付文書と異なるところがあります。添付文書情報は随時更新されます。ご使用の際は、必ず最新の添付文書をご覧下さい。
また、記載されている内容には、専門的な情報が含まれています。文書内の、
この色の文字をクリックすると、別ウィンドウに読み方のアドバイスが表示されます。
この色の文字をクリックすると、別ウィンドウに重大な副作用の解説が表示されます。
この色の文字をクリックすると、別ウィンドウに副作用の症状とその類似語、定義の解説が表示されます。
記載されている情報をご覧になり、疑問などを持たれた場合は、医師・薬剤師にご相談ください。
抗ウイルス化学療法剤
ドルテグラビル+アバカビル+ラミブジン(DTG/ABC/3TC)

- **2024年8月改訂(第8版)
- *2023年8月改訂(第7版)
規制区分:劇薬、処方箋医薬品注)
注)注意-医師等の処方箋により使用すること
| 日本標準商品分類番号 | 87625 |
|---|
| 貯法 | 室温保存 |
|---|---|
| 有効期間 | 3年 |
| 承認番号 | 22700AMX00630000 |
|---|---|
| 販売開始 | 2015年4月 |
1. 警告
1.1 過敏症
1.1.1
海外の臨床試験において、アバカビル投与患者の約5%に過敏症の発現を認めており、まれに致死的となることが示されている。アバカビルによる過敏症は、通常、アバカビル含有製剤による治療開始6週以内(中央値11日)に発現するが、その後も継続して観察を十分に行うこと。[1.1.2 参照],[1.1.3 参照],[1.1.4 参照],[1.1.5 参照],[2.1 参照],[8.2 参照],[8.3 参照],[11.1.1 参照],[15.1.1 参照]
1.1.2
アバカビルによる過敏症では以下の症状が多臓器及び全身に発現する。
- 皮疹
- 発熱
- 胃腸症状(嘔気、嘔吐、下痢、腹痛等)
- 疲労感、倦怠感
- 呼吸器症状(呼吸困難、咽頭痛、咳等) 等
このような症状が発現した場合は、直ちに担当医に報告させ、アバカビルによる過敏症が疑われたときは本剤の投与を直ちに中止すること。[1.1.1 参照],[1.1.3 参照],[1.1.4 参照],[1.1.5 参照],[2.1 参照],[8.2 参照],[8.3 参照],[11.1.1 参照],[15.1.1 参照]
1.1.3
アバカビルによる過敏症が発現した場合には、決してアバカビル含有製剤を再投与しないこと。本製剤の再投与により数時間以内にさらに重篤な症状が発現し、重篤な血圧低下が発現する可能性及び生命を脅かす可能性がある。[1.1.1 参照],[1.1.2 参照],[1.1.4 参照],[1.1.5 参照],[2.1 参照],[8.2 参照],[8.3 参照],[11.1.1 参照],[15.1.1 参照]
1.1.4
呼吸器疾患(肺炎、気管支炎、咽頭炎)、インフルエンザ様症候群、胃腸炎、又は併用薬による副作用と考えられる症状が発現した場合あるいは胸部X線像異常(主に浸潤影を呈し、限局する場合もある)が認められた場合でも、アバカビルによる過敏症の可能性を考慮し、過敏症が否定できない場合は本剤の投与を直ちに中止し、決して再投与しないこと。[1.1.1 参照],[1.1.2 参照],[1.1.3 参照],[1.1.5 参照],[2.1 参照],[8.2 参照],[8.3 参照],[11.1.1 参照],[15.1.1 参照]
1.1.5
患者に過敏症について必ず説明し、過敏症を注意するカードを常に携帯するよう指示すること。また、過敏症を発現した患者には、アバカビル含有製剤を二度と服用しないよう十分指導すること。[1.1.1 参照],[1.1.2 参照],[1.1.3 参照],[1.1.4 参照],[2.1 参照],[8.2 参照],[8.3 参照],[11.1.1 参照],[15.1.1 参照]
1.2
B型慢性肝炎を合併している患者では、ラミブジンの投与中止により、B型慢性肝炎が再燃するおそれがあるので、本剤の投与を中断する場合には十分注意すること。特に非代償性の場合、重症化するおそれがあるので注意すること。[9.1.3 参照]
2. 禁忌(次の患者には投与しないこと)
2.1
本剤の成分に対し過敏症の既往歴のある患者[1.1.1 参照],[1.1.2 参照],[1.1.3 参照],[1.1.4 参照],[1.1.5 参照],[8.2 参照],[8.3 参照],[11.1.1 参照],[15.1.1 参照]
2.2
重度の肝障害患者[9.3.1 参照],[16.6.2 参照]
3. 組成・性状
3.1 組成
| 有効成分 | 1錠中 ドルテグラビルナトリウム52.6mg(ドルテグラビルとして50mg) アバカビル硫酸塩702mg(アバカビルとして600mg) ラミブジン300mg |
|---|---|
| 添加剤 | D-マンニトール、結晶セルロース、ポビドン、デンプングリコール酸ナトリウム、ステアリン酸マグネシウム、ポリビニルアルコール(部分けん化物)、酸化チタン、マクロゴール4000、タルク、黒酸化鉄、三二酸化鉄 |
3.2 製剤の性状
| 剤形・性状 | 紫色のフィルムコーティング錠 |
|---|---|
| 識別コード | 572 Trı |
| 表 (長径×短径) |
 約22mm×約11mm |
| 裏 |  |
| 側面 (厚さ) |
 約7.6mm |
| 質量 | 1720.8mg |
4. 効能又は効果
HIV感染症
5. 効能又は効果に関連する注意
5.1
本剤の使用にあたっては、患者のCD4リンパ球数及び血漿中HIV RNA量を確認すること。
5.2
以下のいずれかのヒト免疫不全ウイルス(HIV)感染症患者に使用すること。
5.2.1
抗HIV薬による治療経験のない患者
5.2.2
インテグラーゼ阻害剤(INSTI)以外の抗HIV薬による治療でウイルス学的抑制が得られていない患者
5.2.3
ウイルス学的抑制が得られている以下のいずれかの患者
- ドルテグラビル、アバカビル、ラミブジンの組み合わせにより治療中の患者
- ウイルス学的失敗の経験がなく、切り替え前6ヵ月間以上においてウイルス学的抑制が得られており、本剤の有効成分に対する耐性関連変異を持たず、本剤への切り替えが適切であると判断される抗HIV薬既治療患者
5.3
INSTIに耐性を有する患者に対して、本剤の使用は推奨されない(ドルテグラビル、アバカビル、ラミブジンの3成分で治療された経験はない)。
5.4
本剤による治療にあたっては、患者の治療歴及び可能な場合には薬剤耐性検査(遺伝子型解析あるいは表現型解析)を参考にすること(ヌクレオシド系逆転写酵素阻害剤(NRTI)による治療経験がある場合には、NRTIに対する耐性変異を有している可能性がある)。
5.5
本剤はドルテグラビル、アバカビル及びラミブジンの固定用量を含有する配合剤であるので、アバカビル又はラミブジンの用量調節が必要な以下の患者には個別のドルテグラビル製剤(テビケイ錠)、アバカビル製剤(ザイアジェン錠)又はラミブジン製剤(エピビル錠)を用いること。
- 腎機能障害(クレアチニンクリアランス(Ccr)が30mL/min未満)を有する患者[9.2.1 参照],[9.2.2 参照],[16.6.1 参照]
- 軽度又は中等度の肝障害患者[9.3.2 参照],[16.6.2 参照]
6. 用法及び用量
通常、成人には1回1錠(ドルテグラビルとして50mg、アバカビルとして600mg及びラミブジンとして300mgを含有)を食事の有無にかかわらず1日1回経口投与する。
7. 用法及び用量に関連する注意
7.1
本剤は、HIV感染症に対して1剤で治療を行うものであるため、他の抗HIV薬と併用しないこと。ただし、ドルテグラビルを追加投与する必要がある場合を除く。[7.2 参照],[10.2 参照]
7.2
本剤とカルバマゼピン、リファンピシン、フェニトイン、ホスフェニトイン、フェノバルビタール、セイヨウオトギリソウ(セント・ジョーンズ・ワート)含有食品を併用する場合は、ドルテグラビルとして50mgを本剤投与の約12時間後に投与する。[7.1 参照],[10.2 参照],[16.7.2 参照]
8. 重要な基本的注意
8.1
本剤による治療は、抗HIV療法に十分な経験を持つ医師のもとで開始すること。
8.2
本剤の再投与を考慮する際は、次のことに注意すること。[1.1.1 参照],[1.1.2 参照],[1.1.3 参照],[1.1.4 参照],[1.1.5 参照],[2.1 参照],[8.3 参照],[11.1.1 参照],[15.1.1 参照]
- アバカビルによる過敏症に関連する症状は、再投与により初回より重篤な再発が認められる。重篤な血圧低下をきたし死に至る可能性があるので、アバカビルによる過敏症が疑われた患者には、決して再投与しないこと。
- アバカビル含有製剤を中止した理由を再度検討し、アバカビルと過敏症との関連性が否定できない場合は再投与しないこと。
- 投与中止前に過敏症の主な症状(皮疹、発熱、胃腸症状等)の1つのみが発現していた患者には、本剤の有益性が危険性を上回ると判断される場合にのみ、必要に応じて入院のもとで投与を行うこと。
- 過敏症の症状又は徴候が認められていなかった患者に対しても、直ちに医療施設に連絡できることを確認した上で投与を行うこと。
*8.3
本剤の使用に際しては、国内外のガイドライン等の最新の情報を参考に、患者又は患者に代わる適切な者に、次の事項についてよく説明し同意を得た後、使用すること。
- 本剤はHIV感染症の根治療法薬ではないことから、日和見感染症を含むHIV感染症の進展に伴う疾病を発症し続ける可能性があるので、本剤投与開始後の身体状況の変化については、すべて担当医に報告すること。
- 本剤は併用薬と相互作用を起こすことがあるため、服用中のすべての薬剤を担当医に報告すること。また、本剤で治療中に新たに他の薬剤を服用する場合には、事前に担当医に報告すること。
- 担当医の指示なしに用量を変更したり、服用を中止したりしないこと。
- アバカビルの投与後過敏症が発現し、まれに致死的となることが報告されている。過敏症を注意するカードに記載されている徴候又は症状である発熱、皮疹、疲労感、倦怠感、胃腸症状(嘔気、嘔吐、下痢、腹痛等)及び呼吸器症状(呼吸困難、咽頭痛、咳等)等が発現した場合は、直ちに担当医に報告し、本剤の服用を中止すべきか否か指示を受けること。また、過敏症を注意するカードは常に携帯すること。[1.1.1 参照],[1.1.2 参照],[1.1.3 参照],[1.1.4 参照],[1.1.5 参照],[2.1 参照],[8.2 参照],[11.1.1 参照],[15.1.1 参照]
- アバカビル含有製剤の再投与により重症又は致死的な過敏症が数時間以内に発現する可能性がある。したがって、本剤の服用を中断した後に再びアバカビル含有製剤を服用する際には、必ず担当医に相談すること。担当医又は医療施設を変わる場合には本剤の服用歴がある旨を新しい担当医に伝えること。[1.1.1 参照],[1.1.2 参照],[1.1.3 参照],[1.1.4 参照],[1.1.5 参照],[2.1 参照],[8.2 参照],[11.1.1 参照],[15.1.1 参照]
- 本剤の長期投与による影響については、現在のところ不明であること。
8.4
本剤を含む抗HIV薬の多剤併用療法を行った患者で、免疫再構築炎症反応症候群が報告されている。投与開始後、免疫機能が回復し、症候性のみならず無症候性日和見感染(マイコバクテリウムアビウムコンプレックス、サイトメガロウイルス、ニューモシスチス等によるもの)等に対する炎症反応が発現することがある。また、免疫機能の回復に伴い自己免疫疾患(甲状腺機能亢進症、多発性筋炎、ギラン・バレー症候群、ブドウ膜炎等)が発現するとの報告があるので、これらの症状を評価し、必要時には適切な治療を考慮すること。
8.5
膵炎が発症する可能性があるので、血清アミラーゼ、血清リパーゼ、トリグリセリド等の生化学的検査を定期的に行うこと。[9.1.1 参照],[11.1.5 参照]
8.6
肝機能障害、黄疸があらわれることがあるので、定期的に肝機能検査を行う等、観察を十分に行うこと。[9.1.2 参照],[11.1.10 参照]
8.7
重篤な血液障害、乳酸アシドーシス、脂肪沈着による重度の肝腫大(脂肪肝)、横紋筋融解症、ニューロパチー、錯乱状態、痙攣、心不全があらわれることがあるので、定期的に検査を行うなど観察を十分に行うこと。[9.2.2 参照],[11.1.4 参照],[11.1.6 参照],[11.1.7 参照],[11.1.8 参照],[11.1.9 参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 膵炎を発症する可能性のある患者(膵炎の既往歴のある患者、膵炎を発症させることが知られている薬剤との併用療法を受けている患者)
膵炎を再発又は発症する可能性がある。本剤の適用を考える場合には、他に十分な効果の認められる治療法がない場合にのみ十分注意して行うこと。[8.5 参照],[11.1.5 参照]
9.1.2 B型又はC型肝炎ウイルス感染患者
肝機能の悪化(トランスアミナーゼ上昇又は増悪)のおそれがある。臨床試験において、B型又はC型肝炎ウイルス重複感染患者では、ドルテグラビルの投与によりトランスアミナーゼ上昇又は増悪の発現頻度が非重複感染患者より高かった。[8.6 参照],[11.1.10 参照]
9.1.3 B型肝炎ウイルス感染を合併している患者
本剤の投与を中断する場合には十分注意すること。B型慢性肝炎を合併している患者では、本剤の投与中止により、B型慢性肝炎が再燃するおそれがある。特に非代償性の場合、重症化するおそれがある。[1.2 参照]
9.2 腎機能障害患者
9.2.1 腎機能障害(Ccrが30mL/min未満)を有する患者
ラミブジンの高い血中濃度が持続するおそれがある。[5.5 参照],[16.6.1 参照]
9.2.2 腎機能障害(Ccrが30~49mL/min)を有する患者
血液検査等をより頻回に行うなど、慎重に患者の状態を観察すること。ラミブジンに関連する副作用の発現が疑われる場合は、個別のドルテグラビル製剤、アバカビル製剤又はラミブジン製剤を用いてラミブジンの用量調節を考慮すること。ラミブジンの高い血中濃度が持続するおそれがある。[5.5 参照],[8.7 参照],[16.6.1 参照]
9.3 肝機能障害患者
9.3.1 重度の肝障害患者
投与しないこと。アバカビルの血中濃度が上昇することにより、副作用が発現するおそれがある。[2.2 参照]
9.3.2 軽度又は中等度の肝障害患者
アバカビルの血中濃度が上昇することにより、副作用が発現するおそれがある。[5.5 参照],[16.6.2 参照]
**9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
海外の観察研究において、無脳症や二分脊椎などの神経管閉鎖障害が、受胎前からドルテグラビル含有製剤を服用していた妊婦から生まれた児9460例中10例(0.11%、95%信頼区間0.06-0.19)に報告されており、ドルテグラビルを含まない抗HIV薬を服用していた妊婦から生まれた児23664例中25例(0.11%、95%信頼区間0.07-0.16)、HIV陰性の妊婦から生まれた児170723例中108例(0.07%、95%信頼区間0.05-0.08)に報告されている1)。
ドルテグラビル、アバカビル及びラミブジンに関して次のことが報告されている。
9.5.1 ドルテグラビル
ドルテグラビルはヒト胎盤を通過する。ドルテグラビルの母体血漿中濃度に対する胎児臍帯血漿中濃度の比(中央値[範囲])は、1.28[1.21-1.28]であることが報告されている2)(外国人データ)。
9.5.2 アバカビル
動物において、アバカビル又はその代謝物は胎盤を通過することが示されている。また、動物(ラットのみ)において、アバカビルの500mg/kg/日又はそれ以上の投与量(臨床用量におけるヒト全身曝露量(AUC)の約28倍)で、胚又は胎児に対する毒性(胎児の浮腫、変異及び奇形、吸収胚、体重減少、死産の増加)が認められたとの報告がある。
9.5.3 ラミブジン
ラミブジンはヒト胎盤を通過する。出生児の血清中ラミブジン濃度は、分娩時の母親の血清中及び臍帯血中濃度と同じであることが報告されている(外国人データ)。
動物実験(ウサギ)で胎児毒性(早期の胚死亡数の増加)が報告されている。
9.5.4 アバカビル/ラミブジン共通
NRTIを子宮内曝露又は周産期曝露された新生児及び乳児において、ミトコンドリア障害によると考えられる軽微で一過性の血清乳酸値の上昇が報告されている。
非常にまれに発育遅延、てんかん様発作、他の神経疾患も報告されている。しかしながら、これら事象とNRTIの子宮内曝露、周産期曝露との関連性は確立していない。
9.6 授乳婦
授乳を避けさせること。一般に、HIVの乳児への移行を避けるため、あらゆる状況下においてHIVに感染した女性は授乳すべきでない。
9.6.1 ドルテグラビル
ドルテグラビルはヒト乳汁中に移行する。ドルテグラビルの母体血漿中濃度に対する乳汁中濃度の比(中央値[範囲])は、0.033[0.021-0.050]であることが報告されている2)(外国人データ)。
9.6.2 アバカビル
アバカビルの母体血漿中濃度に対する乳汁中濃度の比は0.9であることが報告されている3)(外国人データ)。
9.6.3 ラミブジン
経口投与されたラミブジンはヒト乳汁中に排泄されることが報告されている(乳汁中濃度:<0.5-8.2μg/mL)4)(外国人データ)。
ラミブジンの母体血漿中濃度に対する乳汁中濃度の比は0.6~3.3であることが報告されている(外国人データ)。
乳児の血清中のラミブジン濃度は18~28ng/mLであったとの報告がある(外国人データ)。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら注意して投与すること。一般に生理機能(肝機能、腎機能、心機能等)が低下しており、合併症を有している又は他の薬剤を併用している場合が多い。
10. 相互作用
ドルテグラビルは主にUGT1A1の基質であり、一部CYP3A4でも代謝される。また、ドルテグラビルは有機カチオントランスポーター2(OCT2)及びMultidrug and Toxin Extrusion 1(MATE1)を阻害する。[16.4.1 参照],[16.7.1 参照]
10.2 併用注意(併用に注意すること)
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| ピルシカイニド塩酸塩水和物 | ピルシカイニドの血漿中濃度を上昇させる可能性がある。併用により、ピルシカイニドで重大な副作用として報告されている心室頻拍、洞停止及び心室細動等の発現及び重篤化があらわれるおそれがあるので、併用中は注意深く観察すること。 | ドルテグラビルのOCT2及びMATE1の阻害作用により、ピルシカイニドの排出が阻害される可能性がある。 |
| カルバマゼピン [7.2 参照],[16.7.2 参照] |
ドルテグラビルの血漿中濃度をCmaxで33%、Cτで73%低下させたとの報告がある8)。 | カルバマゼピンがCYP3A4及びUGT1A1を誘導することにより、ドルテグラビルの代謝が促進される。 |
| フェニトイン ホスフェニトイン フェノバルビタール セイヨウオトギリソウ(St. John’s Wort, セント・ジョーンズ・ワート)含有食品 [7.1 参照],[7.2 参照] |
ドルテグラビルの血漿中濃度を低下させる可能性がある。 | これらの薬剤並びにセイヨウオトギリソウがCYP3A4及びUGT1A1を誘導することにより、ドルテグラビルの代謝が促進される。 |
| リファンピシン [7.2 参照],[16.7.2 参照] |
ドルテグラビルの血漿中濃度をCmaxで43%、Cτで72%低下させたとの報告がある9)。 | リファンピシンがCYP3A4及びUGT1A1を誘導することにより、ドルテグラビルの代謝が促進される。 |
| 多価カチオン(Mg,Al等)含有製剤 [16.7.2 参照] |
ドルテグラビルの血漿中濃度をCmaxで72%、C24で74%低下させる10)。本剤は多価カチオン含有製剤の投与2時間前又は6時間後の投与が推奨される。 | これらの多価カチオンと錯体を形成することにより、ドルテグラビルの吸収が阻害される。 |
| 鉄剤、カルシウム含有製剤(サプリメント等) [16.7.2 参照] |
ドルテグラビルの血漿中濃度をCmaxで35%、C24で32%低下させる10)。食事と同時に摂取する場合を除き、本剤は鉄剤、カルシウム含有製剤の投与2時間前又は6時間後の投与が推奨される。 | 鉄、カルシウムと錯体を形成することにより、ドルテグラビルの吸収が阻害される。 |
| メトホルミン塩酸塩 [16.7.2参照] |
メトホルミンの血漿中濃度をドルテグラビル50mg1日1回投与時及び1日2回投与時にCmaxでそれぞれ66%及び111%上昇させる11)。注意深く観察し、必要に応じてメトホルミンを減量する等慎重に投与すること。 | ドルテグラビルのOCT2及びMATE1の阻害作用により、メトホルミンの排出が阻害される可能性がある。 |
| アルコール(飲酒) [16.4.2 参照],[16.7.1 参照],[16.7.2 参照] |
アバカビルの代謝はエタノールによる影響を受ける。アバカビルのAUCが約41%増加したが、エタノールの代謝は影響を受けなかったとの報告がある12)。 | アバカビルがアルコールデヒドロゲナーゼの代謝基質として競合すると考えられている。 |
| メサドン塩酸塩 [16.7.2 参照] |
メサドンのクリアランスが22%増加したことから、併用する際にはメサドンの増量が必要となる場合があると考えられる。なお、アバカビルの血中動態は臨床的意義のある影響を受けなかった(Cmaxが35%減少し、tmaxが1時間延長したが、AUCは変化しなかったとの報告がある)。 | 機序不明 |
| スルファメトキサゾール・トリメトプリム [16.7.2 参照] |
ラミブジンのAUCが43%増加し、全身クリアランスが30%、腎クリアランスが35%減少したとの報告がある。 | 腎臓における排泄がラミブジンとトリメトプリムで競合すると考えられている。 |
| ソルビトール | 経口ソルビトール溶液(ソルビトールとして3.2g、10.2g、13.4g)とラミブジンの併用により、ラミブジンのAUCが減少した(それぞれ18%、36%、42%減少)との報告がある。 | ソルビトールによりラミブジンの吸収が抑制されると考えられている。 |
| リオシグアト[16.7.2 参照] | 本剤とリオシグアトの併用により、リオシグアトのAUCが増加するおそれがある。本剤との併用が必要な場合は、患者の状態に注意し、必要に応じてリオシグアトの減量を考慮すること。 | アバカビルのCYP1A1阻害作用によりリオシグアトの代謝が阻害される。 |
11. 副作用
次のような副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1 重大な副作用
11.1.1 過敏症(頻度不明)
アバカビルの投与により発熱又は皮疹を伴う多臓器及び全身性の過敏症があらわれることがあるので、観察を十分に行い、以下に示すような徴候又は症状があらわれた場合には、直ちに投与を中止し、適切な処置を行うこと。[1.1.1 参照],[1.1.2 参照],[1.1.3 参照],[1.1.4 参照],[1.1.5 参照],[2.1 参照],[8.2 参照],[8.3 参照],[15.1.1 参照]
- 皮膚
皮疹注)(通常、斑状丘疹性皮疹又は蕁麻疹)、多形紅斑 - 消化器
嘔気注)、嘔吐注)、下痢注)、腹痛注)、口腔潰瘍 - 呼吸器
呼吸困難注)、咳注)、咽頭痛、急性呼吸促迫症候群、呼吸不全 - 精神神経系
頭痛注)、感覚異常 - 血液
リンパ球減少 - 肝臓
肝機能検査値異常注)(AST、ALT等の上昇)、肝不全 - 筋骨格
筋痛注)、筋変性(横紋筋融解、筋萎縮等)、関節痛、CK上昇 - 泌尿器
クレアチニン上昇、腎不全 - 眼
結膜炎 - その他
発熱注)、嗜眠注)、倦怠感注)、疲労感注)、浮腫、リンパ節腫脹、血圧低下、粘膜障害、アナフィラキシー
注)アバカビルによる過敏症発現患者のうち10%以上にみられた症状
11.1.2 薬剤性過敏症症候群(頻度不明)
初期症状として発疹、発熱がみられ、さらに肝機能障害、リンパ節腫脹、好酸球増多等を伴う遅延性の重篤な過敏症状があらわれることがある。なお、投与中止後も発疹、発熱、肝機能障害等の症状が再燃あるいは遷延化することがあるので注意すること。
11.1.3 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)及び皮膚粘膜眼症候群(Stevens-Johnson症候群)、多形紅斑(頻度不明)
発熱、眼充血、顔面の腫脹、口唇・口腔粘膜や陰部のびらん、皮膚や粘膜の水疱、紅斑、咽頭痛、そう痒、全身倦怠感等の異常が認められた場合には直ちに投与を中止し、適切な処置を行うこと。
11.1.4 重篤な血液障害(1%未満)
赤芽球癆、汎血球減少、貧血、白血球減少、好中球減少、血小板減少[8.7 参照]
11.1.5 膵炎(頻度不明)
血清アミラーゼ、血清リパーゼ、トリグリセリド等の検査値の上昇がみられた場合には、直ちに本剤の投与を中止すること。また、重度の腹痛、悪心・嘔吐等の症状がみられた場合にも直ちに本剤の投与を中止し、生化学的検査(血清アミラーゼ、血清リパーゼ、トリグリセリド等)及び画像診断等による観察を十分行うこと。[8.5 参照],[9.1.1 参照]
11.1.6 乳酸アシドーシス及び脂肪沈着による重度の肝腫大(脂肪肝)(頻度不明)
乳酸アシドーシス又は肝毒性が疑われる臨床症状や検査値異常が認められた場合には、本剤の投与を一時中止すること。特に、肝疾患の危険因子を有する患者においては注意すること。アバカビル及びラミブジンを含むNRTIの単独投与又はこれらの併用療法により、重篤な乳酸アシドーシス(全身倦怠、食欲不振、急な体重減少、胃腸障害、呼吸困難、頻呼吸等)、肝毒性(脂肪沈着による重度の肝腫大、脂肪肝を含む)が、女性に多く報告されている。[8.7 参照]
11.1.7 横紋筋融解症(頻度不明)
[8.7 参照]
11.1.8 ニューロパチー(頻度不明)、錯乱状態(1%未満)、痙攣(頻度不明)
[8.7 参照]
11.1.9 心不全(1%未満)
[8.7 参照]
11.1.10 肝機能障害(1%未満)、黄疸(頻度不明)
AST、ALT、ビリルビンの上昇等を伴う肝機能障害、黄疸があらわれることがある。[8.6 参照],[9.1.2 参照]
11.2 その他の副作用
| 1%以上 | 1%未満 | 頻度不明 | |
|---|---|---|---|
| 免疫系 | 免疫再構築炎症反応症候群 | ||
| 精神・神経系 | 不眠症、頭痛、浮動性めまい、異常な夢、うつ病、傾眠、睡眠障害 | 錯感覚、不安、嗜眠、自殺企図 | 末梢性ニューロパチー、感情障害、自殺念慮 |
| 消化器 | 悪心、下痢、嘔吐、鼓腸、腹部膨満、消化不良、腹部不快感、胃食道逆流性疾患 | 上腹部痛、腹痛、胃炎 | 痔核、腹部硬直 |
| 肝臓 | 肝炎 | ||
| 皮膚 | そう痒症、脱毛症 | 発疹、ざ瘡、多汗症、皮膚炎 | 湿疹、毛包炎 |
| 全身症状 | 疲労、無力症 | 異常感、熱感、インフルエンザ様疾患、酩酊感、易刺激性、乳頭炎 | 発熱、体温調節障害、疼痛、倦怠感 |
| 代謝及び栄養障害 | 食欲減退 | 体脂肪の再分布/蓄積(胸部、体幹部の脂肪増加、末梢部、顔面の脂肪減少、野牛肩、血清脂質増加、血糖増加)、アミラーゼ増加、高乳酸血症、脱水 | |
| 耳及び迷路障害 | 耳管炎 | ||
| 筋骨格 | 関節痛、筋肉痛、筋痙直 | 筋障害、骨痛 | |
| 感染症 | 鼻炎 | 敗血症 | |
| 呼吸器 | 咳嗽 | 呼吸困難、口腔咽頭痛、肺炎、気管支炎、副鼻腔炎、呼吸障害、上気道の炎症 | |
| 血液 | リンパ球減少症、リンパ節症 | ||
| 心臓 | 心筋症 | ||
| 臨床検査 | ALT増加、AST増加、血中ビリルビン増加、血中クレアチニン増加、肝機能検査異常、血中ブドウ糖増加、体重増加 | 体重減少、血中ブドウ糖減少、総蛋白増加、総蛋白減少、血中重炭酸塩増加、血中重炭酸塩減少、血中クレアチンホスホキナーゼ増加、血中トリグリセリド増加、血中コレステロール増加、血中尿酸増加、平均赤血球容積増加 |
13. 過量投与
13.1 処置
ドルテグラビルは血液透析により除去される可能性は低いことが報告されている13),14)。ラミブジンは血液透析により一部除去される(ラミブジン300mg投与時に、投与約2時間後から4時間血液透析したとき、AUC0-infが約24%低下することが報告されている)68)。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1
海外で実施されたプロスペクティブ試験(1956例)において、アバカビルの投与開始前にHLA-B*5701のスクリーニングを実施しない群と、スクリーニングを実施しHLA-B*5701保有者を除外した群における臨床症状から疑われる過敏症の発現頻度が、それぞれ7.8%(66/847)、3.4%(27/803)、皮膚パッチテストにより確認された過敏症の発現頻度が、それぞれ2.7%(23/842)、0.0%(0/802)であり、HLA-B*5701のスクリーニングの実施により過敏症の発現頻度が統計学的に有意に低下する(p<0.0001)ことが示された。また、本試験結果ではHLA-B* 5701 をスクリーニングしない群において臨床症状から過敏症が疑われた66例中30例、皮膚パッチテストにて確認された過敏症症例23例全例がHLA-B*5701を有していた。
日本人における過敏症とHLA-B*5701保有の関連性については不明であり、HLA-B*5701の保有率は白人では5~8%、日本人では0.1%との報告がある。[1.1.1 参照],[1.1.2 参照],[1.1.3 参照],[1.1.4 参照],[1.1.5 参照],[2.1 参照],[8.2 参照],[8.3 参照],[11.1.1 参照]
15.1.2
抗HIV薬の多剤併用療法を受けている患者を対象に心筋梗塞の発現頻度を調査したプロスペクティブ観察疫学研究において、アバカビルの使用開始から6ヵ月以内の患者で心筋梗塞のリスクが増加するとの報告があるが、臨床試験の統合解析を実施した結果、対照群と比較してアバカビル投与群の過度な心筋梗塞のリスクは認められなかった。アバカビルと心筋梗塞の関連については、現在のところ結論は出ていない。予防措置として、アバカビルを含む抗HIV療法を開始する場合には、冠動脈性心疾患の潜在的リスクを考慮し、高血圧、高脂血症、糖尿病、喫煙等の改善可能なすべてのリスク因子を最小化させるための措置をとること。
15.2 非臨床試験に基づく情報
15.2.1 ラミブジン
遺伝毒性試験において弱い染色体異常誘発作用を示したとの報告がある。また、長期のがん原性試験において発がん性を認めなかったとの報告がある。
ヒト末梢血リンパ球を用いた染色体異常試験では300μg/mL以上、マウスリンパ腫細胞を用いた遺伝子突然変異試験では2000μg/mL以上で陽性を示した。
マウス及びラットを用いた長期のがん原性試験では、臨床用量におけるヒト全身曝露量(AUC)の10倍(マウス)及び58倍(ラット)までの曝露量において、発がん性は認められなかった。
15.2.2 アバカビル
(1)
細菌を用いた試験では変異原性を認めなかったが、ヒトリンパ球を用いたin vitro染色体異常試験、マウスリンフォーマ試験及びin vivo小核試験では陽性を認めた。これらの結果は、in vivo及びin vitroにおいて、本剤の高濃度を用いた場合に弱い染色体異常誘発作用を有することを示している。
(2)
マウス及びラットにおける長期がん原性試験において、包皮腺、陰核腺、肝臓、膀胱、リンパ節、皮下組織等に悪性腫瘍がみられたとの報告がある(臨床用量におけるヒト全身曝露量(AUC)の21~28倍。ただし包皮腺(ヒトにおいて該当する器官は存在しない)の腫瘍については約5倍。)ので、ヒトに対する潜在的危険性と治療上の有益性を十分に検討すること。
(3)
アバカビルを2年間投与したマウス及びラットにおいて、軽度心筋変性が認められた(臨床用量におけるヒト全身曝露量(AUC)の7~21倍の用量)。
16. 薬物動態
16.1 血中濃度
16.1.1 単回経口投与
健康成人12例に本剤を空腹時に単回経口投与した時の血漿中ドルテグラビル、アバカビル及びラミブジンの薬物動態パラメータを表-1に示す15)。
| Cmax (μg/mL) |
AUC0-inf (μg・h/mL) |
AUC0-t (μg・h/mL) |
Tmax注1) (h) |
t1/2 (h) |
|
|---|---|---|---|---|---|
| ドルテグラビル | 4.21±0.84 | 75.2±15.1 | 73.0±14.6 | 3.50 (1.02-5.00) |
14.0±2.77 |
| アバカビル | 5.38±1.44 | 18.7±4.0 | 18.6±4.0 | 1.01 (0.98-3.00) |
2.84±1.06 |
| ラミブジン | 3.43±0.81 | 16.8±1.7 | 16.7±1.7 | 2.98 (2.00-4.00) |
19.6±5.59 |
平均値±標準偏差、12例
注1)中央値(範囲)
健康成人62例に本剤を空腹時に単回経口投与した時の血漿中ドルテグラビル、アバカビル及びラミブジンの薬物動態パラメータを表-2に示す16)(外国人データ)。
| Cmax (μg/mL) |
AUC0-inf (μg・h/mL) |
AUC0-t (μg・h/mL) |
Tmax注1) (h) |
t1/2 (h) |
|
|---|---|---|---|---|---|
| ドルテグラビル | 2.53±0.70 | 47.12±15.41 | 42.75±13.15 | 3.00 (1.0-8.0) |
13.00±2.72 |
| アバカビル | 4.13±0.95 | 14.35±3.54 | 14.32±3.53 | 2.00 (0.5-3.0) |
2.69±0.84 |
| ラミブジン | 2.20±0.64 | 13.13±3.22 | 12.70±3.24 | 3.00 (1.0-5.0) |
16.28±7.69 |
平均値±標準偏差、62例
注1)中央値(範囲)
健康成人男性6例及び女性4例にドルテグラビル製剤50mgを単回経口投与した時の血漿中ドルテグラビルの薬物動態パラメータを表-3に示す。ドルテグラビルは投与後約3時間で最高血漿中濃度に達し、消失半減期は約15時間であった。また、日本人における薬物動態は外国人における薬物動態と同様であった17)。
| Cmax (μg/mL) |
Tmax注1) (h) |
AUC0-inf (μg・h/mL) |
t1/2 (h) |
C24 (μg/mL) |
|---|---|---|---|---|
| 2.37±1.23 | 3.0(2.0-4.0) | 47.7±24.6 | 14.7±1.56 | 0.73±0.36 |
平均値±標準偏差、10例
注1)中央値(範囲)
ドルテグラビル製剤は経口投与により速やかに吸収され、投与後約2~3時間で最高血漿中濃度に達した。HIV感染症患者及び健康成人にドルテグラビル製剤を経口投与した時の血漿中ドルテグラビルの曝露量は、2~100mg注)の範囲では投与量増加の割合を下回って増加した18),19)が、25~50mg注)の範囲では投与量にほぼ比例して増加した20)(外国人データ)。
HIV感染症患者9例にアバカビル・ラミブジン製剤(600mg・300mg)を空腹時単回投与した時のアバカビル、ラミブジンの薬物動態パラメータを表-4に示す21)。
| Cmax (μg/mL) |
AUClast (μg・h/mL) |
AUC0-τ (μg・h/mL) |
Tmax注1) (h) |
t1/2 (h) |
|
|---|---|---|---|---|---|
| アバカビル | 5.68±2.04 | 12.56±4.01 | 12.89±4.22 | 1.00 (0.50-1.03) |
1.50±0.16 |
| ラミブジン | 3.58±0.61 | 13.81±3.56 | 16.30±5.058 | 2.00 (1.00-3.00) |
2.49±0.55 |
平均値±標準偏差、9例
注1)中央値(範囲)
HIV感染症患者12例にアバカビル製剤100、300、600、900、1200mg注)を単回経口投与した場合、Cmax及びAUC0-infは投与量に依存して上昇した。未変化体の血漿中濃度は投与約1.5時間後に最高濃度に達し、消失半減期は約1.5時間であった22)(外国人データ)。
16.1.2 反復経口投与
HIV感染症患者20例にアバカビル製剤300mg注)を1日2回投与した場合の定常状態におけるCmaxは約3μg/mL、12時間までのAUCは約6μg・h/mLであった23)(外国人データ)。
HIV感染症患者27例にアバカビル製剤600mg1日1回投与時とアバカビル製剤300mg注)1日2回投与時の定常状態における薬物動態パラメータを比較した結果、細胞内カルボビル三リン酸の曝露は、アバカビル製剤600mg1日1回投与時の方が大きく、AUC0-24、Cmax及びCτがそれぞれ32%、99%及び18%増加した(外国人データ)。
成人HIV感染症患者にラミブジン2mg/kgを1日2回注)15日間経口投与した時、初回投与時では投与1.5時間後に最高血中濃度の1.5μg/mLに達し、半減期は2.6時間であり、15日間投与後では血中濃度は定常状態に達し、最高血中濃度は1.9μg/mLであった(外国人データ)24)。
16.1.3 生物学的同等性
健康成人62例に、本剤1錠、ドルテグラビル製剤50mg及びアバカビル・ラミブジン製剤(600mg・300mg)各1錠を空腹時に単回経口投与し、生物学的同等性を評価した。
本剤投与時とドルテグラビル製剤及びアバカビル・ラミブジン製剤の併用投与時のドルテグラビル、アバカビル及びラミブジンのAUC0-t、AUC0-inf及びCmaxは、生物学的同等性の判定基準(平均値の比の90%信頼区間が0.80~1.25の範囲内)を満たし、生物学的同等性が示された(外国人データ)。
16.2 吸収
16.2.1 食事の影響
健康成人12例に、高脂肪食(869kcal、53%が脂肪由来)摂取後に本剤を経口投与した時、空腹時投与時と比較して、ドルテグラビルのAUC0-inf及びCmaxがそれぞれ48及び37%増加した。また、ラミブジンのAUC0-inf及びCmax、アバカビルのAUC0-infに変化は認められなかったが、アバカビルのCmaxは23%低下した(外国人データ)。
16.2.2 バイオアベイラビリティ
(1) アバカビル硫酸塩
HIV感染症患者にアバカビル錠300mg注)を単回経口投与した時の生物学的利用率は約83%であった26)(外国人データ)。
(2) ラミブジン
HIV感染症患者にラミブジンのカプセル製剤0.25~8mg/kg注)を単回経口投与した時の生物学的利用率は約82%であった25)(外国人データ)。
16.3 分布
16.3.1 ドルテグラビル
(1) 血漿蛋白結合率
In vitroにおいて、ドルテグラビルのヒト血漿蛋白結合率は約99.3%であった27)。
(2) 分布容積
健康成人男性にドルテグラビル20mg(懸濁液)注)を単回経口投与した時の見かけの分布容積は12.5Lであった(外国人データ)。
(3) 血球移行性
ヒトでの血液/血漿比(平均値)は0.441~0.535であり、ドルテグラビルの血球移行性は低かった(5%未満)。
(4) 非結合型薬物
血漿中ドルテグラビルの遊離分画は健康成人で約0.2~1.1%、中等度の肝機能障害患者で約0.4~0.5%、重度の腎機能障害患者で約0.8~1.0%、HIV感染症患者で0.5%であった(外国人データ)。
(5) 脳脊髄液への移行
ドルテグラビルは脳脊髄液中にも分布する。ドルテグラビル製剤50mg及びアバカビル・ラミブジン製剤(600mg・300mg)が併用投与された抗HIV薬による治療経験のない成人HIV感染症患者11例において、ドルテグラビルの脳脊髄液中濃度(中央値)は18ng/mLであり、血漿中濃度の0.11~0.66%であった(外国人データ)。
(6) 組織内分布
ドルテグラビルは女性及び男性の生殖器に分布する。
健康成人女性にドルテグラビル製剤50mg/日を5~7日間経口投与した時の子宮頸膣液、子宮頸部組織及び膣組織におけるドルテグラビルのAUCは定常状態での血漿中ドルテグラビルのAUCの6~10%であった(外国人データ)。
また、健康成人男性にドルテグラビル製剤50mg/日を8日間経口投与した時の精液及び直腸組織におけるドルテグラビルのAUCは定常状態での血漿中ドルテグラビルのAUCの7%及び17%であった(外国人データ)。
16.3.2 アバカビル
(1) 分布容積
HIV感染症患者6例を対象にアバカビルを150mg静脈内投与注)した時の見かけの分布容積は約0.86L/kgであり、広く組織に分布することが示唆された26),66)(外国人データ)。
(2) 脳脊髄液への移行
HIV感染症患者におけるアバカビルの脳脊髄液(CSF)への移行は良好で、血漿中AUCに対するCSF中AUCの比は31~44%であった30)(外国人データ)。アバカビル600mg1日2回注)投与時の最高濃度の実測値はIC50(0.08μg/mLあるいは0.26μM)の9倍超であった66)(外国人データ)。
(3) 血漿蛋白結合率
In vitroにおいて、アバカビルは10μg/mLまでの添加濃度範囲で、ヒト血漿蛋白結合率は49%と一定であった66)。
(4) 血球移行性
血液及び血漿中放射能濃度が同じであったことから、アバカビルは血球に直ちに分布することが示された66)。
16.3.3 ラミブジン
成人HIV感染症患者に4~10mg/kg注)を1日2回2週間以上反復経口投与した時、投与2時間後の脳脊髄液中濃度は血中濃度の約6%であった31)(外国人データ)。
16.4 代謝
16.4.1 ドルテグラビル
In vitroにおいて、ドルテグラビルは主に肝臓のUGT1A1でグルクロン酸抱合される32)。また、ドルテグラビルはCYP3Aでも一部代謝された33)。[10. 参照]
16.4.2 アバカビル
ヒトでの主代謝物は、5'-カルボン酸体及び5'-グルクロン酸抱合体であった30)(外国人データ)。ヒト肝由来試料を用いたin vitro試験から、アバカビルは肝可溶性画分により酸化的代謝を受け5'-カルボン酸体を生成したが、肝ミクロソーム画分ではアバカビルの酸化的代謝は起こらなかった。なお、これらの代謝物には抗ウイルス活性はなかった。
アバカビルの酸化的代謝にはCYPではなく、アルコールデヒドロゲナーゼ/アルデヒドデヒドロゲナーゼが関与していた。[10.2 参照],[16.7.1 参照],[16.7.2 参照]
また、ヒトUGT発現系を用いたin vitro試験において、アバカビルはUGT2B7でのみ代謝された34)。
アバカビルは細胞内で活性代謝物であるカルボビル三リン酸に代謝される。HIV感染症患者20例にアバカビル300mg注)1日2回投与した時の定常状態における細胞内カルボビル三リン酸の半減期は20.6時間であった(外国人データ)。
16.4.3 ラミブジン
ヒトでの主代謝物はトランス-スルホキシド体(1-[(2R,5S)-trans-2-hydroxymethyl-1,3-oxathiolan-3-oxide-5-yl]cytosine)であった37)(外国人データ)。
16.5 排泄
16.5.1 ドルテグラビル
健康成人にドルテグラビル20mg注)を単回経口投与した時の主な排泄経路は糞であり、経口投与量の53%が未変化体として糞中に排泄された。また、尿中には経口投与量の31%が排泄され、その内訳は18.9%がエーテル型グルクロン酸抱合体、3.6%がN-脱アルキル体、3.0%がベンジル位の酸化体であり、未変化体は1%未満であった(外国人データ)。健康成人に14C-ドルテグラビル20mg(懸濁液)注)を単回経口投与した時の総投与量の約9.7%が酸化的代謝物として尿糞中に回収された(外国人データ)。
16.5.2 アバカビル
HIV感染症患者6例に14C標識アバカビル600mgを単回経口投与後、薬物体内動態を検討した。総放射能の約99%が排泄され、主な排泄経路は尿(約83%)であり、糞中には約16%排泄された。尿中に排泄された放射能の約1%は未変化体であり、約30%が5'-カルボン酸体、約36%が5'-グルクロン酸抱合体であった30)(外国人データ)。
16.5.3 ラミブジン
成人HIV感染症患者にラミブジン2mg/kg注)を経口投与した時、投与後12時間尿中にトランス-スルホキシド体が投与量の5.2%排泄された。また、血中濃度が定常状態での未変化体の尿中排泄率は投与量の約70%であり、腎排泄がラミブジンの体内からの除去の主要な経路であることが示された37)(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
(1) ドルテグラビル
重度の腎機能障害(8例、Ccr:30mL/min未満)を有する患者にドルテグラビル製剤50mgを単回経口投与した。その結果、重度の腎機能障害患者における薬物動態は健康成人との間に臨床的に重要である差はみられなかったことから、腎機能障害患者に対してドルテグラビル製剤の用量調節を行う必要はない40)(外国人データ)。
(2) アバカビル
腎機能障害患者(GFR:<10mL/min)におけるアバカビルの薬物動態は、腎機能が正常な患者の薬物動態と同様であった41)(外国人データ)。
(3) ラミブジン
腎機能の低下したHIV感染症患者にラミブジンを300mg注)単回経口投与した時、Ccrの低下につれてAUC及び最高血中濃度が増加し、半減期が延長し、見かけの全身クリアランスが減少した42)(外国人データ)。[5.5 参照],[9.2.1 参照],[9.2.2 参照]
16.6.2 肝機能障害患者
(1) ドルテグラビル
ドルテグラビルは主に肝臓で代謝されて排泄される。中等度の肝機能障害(8例、Child-Pugh分類:B)を有する患者にドルテグラビル製剤50mgを単回経口投与した。その結果、中等度の肝機能障害患者における薬物動態は健康成人と同様であったことから 、中等度の肝機能障害に対してドルテグラビル製剤の用量調節の必要はない43)(外国人データ)。なお、重度の肝機能障害患者でのドルテグラビルの薬物動態に及ぼす影響については検討していない。
(2) アバカビル
軽度の肝障害(Child-Pugh分類の合計点数:5)を有するHIV感染症患者におけるアバカビルの薬物動態を検討した結果、AUC及び消失半減期は肝障害を有さないHIV感染症患者のそれぞれ1.89倍及び1.58倍であった。代謝物の体内消失速度にも変化が認められたが、AUCは肝障害による影響を受けなかった44)(外国人データ)。なお、これら患者に対する推奨投与量は明らかでない。[5.5 参照]
(3) ラミブジン
中等度及び重度の肝障害を有する患者における成績より、ラミブジンの薬物動態は、肝障害によって重大な影響を受けないことが示されている45)(外国人データ)。
16.6.3 B型肝炎及びC型肝炎のウイルス重複感染患者
C型肝炎ウイルス重複感染患者を対象とした母集団薬物動態解析の結果、C型肝炎ウイルス重複感染はドルテグラビルの曝露量に対して臨床的な影響を及ぼさなかった(外国人データ)。なお、B型肝炎ウイルス重複感染患者におけるドルテグラビル製剤投与時の薬物動態データは限られている。
アバカビル及びラミブジンに対して、B型肝炎及びC型肝炎ウイルス重複感染が薬物動態に及ぼす影響については検討されていない。
16.6.4 小児等
小児患者における本剤の薬物動態は確立していない。
12歳以上18歳未満の小児患者におけるドルテグラビル、アバカビル及びラミブジンの薬物動態は成人と同様であった(外国人データ)。
16.6.5 性別
健康成人にドルテグラビル250mg(懸濁液)注)を単回経口投与した時の血漿中ドルテグラビルの薬物動態パラメータは、男性(17例)よりも女性(24例)の方がわずか(最大約20%)に高い傾向がみられた(外国人データ)。
成人HIV感染症患者を対象とした後期第II相及び第III相試験での母集団薬物動態解析の結果、性別はドルテグラビルの曝露量に対して臨床的な影響を及ぼさなかった(外国人データ)。
アバカビル及びラミブジンに対しても、性別は臨床的な影響を及ぼさなかった(外国人データ)。
16.6.6 人種
成人HIV感染症患者を対象とした後期第II相及び第III相試験での母集団薬物動態解析の結果、人種はドルテグラビルの曝露量に対して臨床的な影響は認められなかった。アバカビル及びラミブジンに対しても、人種は臨床的な影響を及ぼさなかった(外国人データ)。
16.7 薬物相互作用
16.7.1 In vitro試験
(1) ドルテグラビル
分布に関わるトランスポーター:ドルテグラビルは、ヒトPgp及びBCRPの基質である28),29)。
排泄に関わるトランスポーター:ドルテグラビルは、ヒト有機アニオントランスポーター1(OAT1)、OAT3、OCT2、MATE1及びMATE2-Kを介した輸送を阻害した(IC50:それぞれ2.12、1.97、1.93、6.34及び24.8μM)35),36)。[10. 参照]
(2) アバカビル
In vitro試験において、アバカビルはCYP1A1を阻害し、CYP3A4もわずかに阻害した69)が、CYP2D6及び2C9を阻害しなかった23)。また、アバカビルは主代謝酵素であるアルコールデヒドロゲナーゼ/アルデヒドデヒドロゲナーゼを阻害しなかった。[10.2 参照],[16.4.2 参照],[16.7.2 参照]
(3) ラミブジン
排泄に関わるトランスポーター:ラミブジンはOCT2、MATE1及びMATE2-Kの基質である38),39)。
16.7.2 臨床薬物相互作用試験
(1) ドルテグラビル単独投与での成績
ドルテグラビルを併用薬と投与した時の薬物動態パラメータの変化を、表-5及び表-6に示す(外国人データ)。[7.2 参照],[10.2 参照]
| 併用薬及び用量 | ドルテグラビル |
例数 | ドルテグラビル併用時/非併用時の 併用薬の薬物動態パラメータの 幾何平均比(90%信頼区間); |
||
|---|---|---|---|---|---|
| Cτ又はC24 | AUC | Cmax | |||
| エチニルエストラジオール 0.035mg | 50mg 1日2回 |
15 | 1.02 (0.93,1.11) |
1.03 (0.96,1.11) |
0.99 (0.91,1.08) |
| メサドン 20-150mg | 50mg 1日2回 |
11 | 0.99 (0.91,1.07) |
0.98 (0.91,1.06) |
1.00 (0.94,1.06) |
| ミダゾラム 3mg | 25mg 1日1回 |
10 | - | 0.95 (0.79,1.15) |
- |
| Norelgestromin (国内未発売) 0.25mg |
50mg 1日2回 |
15 | 0.93 (0.85,1.03) |
0.98 (0.91,1.04) |
0.89 (0.82,0.97) |
| リルピビリン 25mg 1日1回 |
50mg 1日1回 |
16 | 1.21 (1.07,1.38) |
1.06 (0.98,1.16) |
1.10 (0.99,1.22) |
| テノホビル ジソプロキシルフマル酸塩 300mg 1日1回 |
50mg 1日1回 |
15 | 1.19 (1.04,1.35) |
1.12 (1.01,1.24) |
1.09 (0.97,1.23) |
| メトホルミン 500mg 1日2回 |
50mg 1日1回 |
14 | - | 1.79 (1.65,1.93) |
1.66 (1.53,1.81) |
| メトホルミン 500mg 1日2回 |
50mg 1日2回 |
14 | - | 2.45 (2.25,2.66) |
2.11 (1.91,2.33) |
| 併用薬及び用量 | ドルテグラビル |
例数 | 他剤併用時/非併用時のドルテグラビルの 薬物動態パラメータの幾何平均比 (90%信頼区間); |
||
|---|---|---|---|---|---|
| Cτ又はC24 | AUC | Cmax | |||
| アタザナビル 400mg 1日1回 |
30mg 1日1回 |
12 | 2.80 (2.52,3.11) |
1.91 (1.80,2.03) |
1.50 (1.40,1.59) |
| アタザナビル+リトナビル 300mg+100mg 1日1回 |
30mg 1日1回 |
12 | 2.21 (1.97,2.47) |
1.62 (1.50,1.74) |
1.34 (1.25,1.42) |
| テノホビル ジソプロキシルフマル酸塩 300mg 1日1回 |
50mg 1日1回 |
15 | 0.92 (0.82,1.04) |
1.01 (0.91,1.11) |
0.97 (0.87,1.08) |
| ダルナビル+リトナビル 600mg+100mg |
30mg 1日1回 |
15 | 0.62 (0.56,0.69) |
0.78 (0.72,0.85) |
0.89 (0.83,0.97) |
| エファビレンツ6) 600mg 1日1回 |
50mg 1日1回 |
12 | 0.25 (0.18,0.34) |
0.43 (0.35,0.54) |
0.61 (0.51,0.73) |
| エトラビリン5) 200mg 1日2回 |
50mg 1日1回 |
15 | 0.12 (0.09,0.16) |
0.29 (0.26,0.34) |
0.48 (0.43,0.54) |
| エトラビリン+ダルナビル+リトナビル 200mg+600mg+100mg 1日2回 |
50mg 1日1回 |
9 | 0.63 (0.52,0.76) |
0.75 (0.69,0.81) |
0.88 (0.78,1.00) |
| ホスアンプレナビル+リトナビル7) 700mg+100mg 1日2回 |
50mg 1日1回 |
12 | 0.51 (0.41,0.63) |
0.65 (0.54,0.78) |
0.76 (0.63,0.92) |
| ロピナビル・リトナビル 400mg・100mg 1日2回 |
30mg 1日1回 |
15 | 0.94 (0.85,1.05) |
0.97 (0.91,1.04) |
1.00 (0.94,1.07) |
| 乾燥水酸化アルミニウムゲル・水酸化マグネシウム 20mL 単回 |
50mg 単回 |
16 | 0.26 (0.21,0.31) |
0.26 (0.22,0.32) |
0.28 (0.23,0.33) |
| 乾燥水酸化アルミニウムゲル・水酸化マグネシウム 20mL 投与後2時間 単回 |
50mg 単回 |
16 | 0.70 (0.58,0.85) |
0.74 (0.62,0.90) |
0.82 (0.69,0.98) |
| 総合ビタミン剤 1錠 1日1回 |
50mg 単回 |
16 | 0.68 (0.56,0.82) |
0.67 (0.55,0.81) |
0.65 (0.54,0.77) |
| オメプラゾール 40mg 1日1回 |
50mg 単回 |
12 | 0.95 (0.75,1.21) |
0.97 (0.78,1.20) |
0.92 (0.75,1.11) |
| prednisone (国内未発売) 60mg 1日1回 (漸減) |
50mg 1日1回 |
12 | 1.17 (1.06,1.28) |
1.11 (1.03,1.20) |
1.06 (0.99,1.14) |
| リファンピシン注1) 600mg 1日1回 |
50mg 1日2回注1) |
11 | 0.28 (0.23,0.34) |
0.46 (0.38,0.55) |
0.57 (0.49,0.65) |
| リファンピシン注2) 600mg 1日1回 |
50mg 1日2回注2) |
11 | 1.22 (1.01,1.48) |
1.33 (1.15,1.53) |
1.18 (1.03,1.37) |
| リファブチン 300mg 1日1回 |
50mg 1日1回 |
9 | 0.70 (0.57,0.87) |
0.95 (0.82,1.10) |
1.16 (0.98,1.37) |
| リルピビリン 25mg 1日1回 |
50mg 1日1回 |
16 | 1.22 (1.15,1.30) |
1.12 (1.05,1.19) |
1.13 (1.06,1.21) |
| Tipranavir (国内未発売)+リトナビル 500mg+200mg 1日2回 |
50mg 1日1回 |
14 | 0.24 (0.21,0.27) |
0.41 (0.38,0.44) |
0.54 (0.50,0.57) |
| テラプレビル 750mg 8時間ごと |
50mg 1日1回 |
15 | 1.37 (1.29,1.45) |
1.25 (1.20,1.31) |
1.19 (1.11,1.26) |
| Boceprevir (国内未発売) 800mg 8時間ごと |
50mg 1日1回 |
13 | 1.08 (0.91,1.28) |
1.07 (0.95,1.20) |
1.05 (0.96,1.15) |
| カルバマゼピン 300mg 1日2回 |
50mg 1日1回 |
14 | 0.27 (0.24,0.31) |
0.51 (0.48,0.55) |
0.67 (0.61,0.73) |
注1)ドルテグラビル50mg1日2回投与とリファンピシンを併用したドルテグラビル50mg1日2回投与との比較
注2)ドルテグラビル50mg1日1回投与とリファンピシンを併用したドルテグラビル50mg1日2回投与との比較
(2) アバカビル単独投与での成績
ヒト肝スライスを用いたin vitro試験において、HIVプロテアーゼ阻害剤であるアンプレナビルはアバカビルの代謝を阻害しなかった。
アバカビルが併用薬の薬物動態に及ぼす影響を表-7に、併用薬がアバカビルの薬物動態に及ぼす影響を表-8に示す(外国人データ)。[10.2 参照],[16.4.2 参照],[16.7.1 参照]
| 併用薬及び用量 | アバカビル |
例数 | アバカビル併用時/非併用時の併用薬の 薬物動態パラメータの幾何平均比 (90%信頼区間); |
||
|---|---|---|---|---|---|
| CLss/F | AUC | Cmax | |||
| メサドン46) 40mg |
アバカビル 600mg1日2回 |
11 | 1.22 (1.06-1.42) |
- | - |
| 併用薬及び用量 | アバカビル |
例数 | 他剤併用時/非併用時のアバカビルの 薬物動態パラメータの幾何平均比 (90%信頼区間); |
||
|---|---|---|---|---|---|
| CL/F | AUC | Cmax | |||
| メサドン46) 40mg |
アバカビル 600mg1日2回 |
12 | 1.18 (0.96,1.43) |
0.85 (0.70-1.04) |
0.65 (0.53,0.80) |
| エタノール12) 0.7g/kg |
アバカビル 600mg単回 |
24 | - | 1.41 (1.35-1.48) |
1.15 (1.03,1.28) |
(3) ラミブジン単独投与での成績
併用薬がラミブジンの薬物動態に及ぼす影響を表-9に示す(外国人データ)。[10.2 参照]
| 併用薬及び用量 | ラミブジン |
例数 | 他剤併用時/非併用時のラミブジンの 薬物動態パラメータの幾何平均比 (90%信頼区間); |
||
|---|---|---|---|---|---|
| CL/F | AUC | CLr | |||
| トリメトプリム・スルファメトキサゾール 160mg・800mg/日 5日間 |
ラミブジン 300mg単回 |
14 | 0.70 (0.65,0.76) |
1.43 (1.32,1.55) |
0.65 (0.54,0.78) |
(4) リオシグアトの曝露量に及ぼす影響
アバカビル・ドルテグラビル・ラミブジン600mg・50mg・300mg注)を投与中の成人HIV感染症患者にリオシグアト0.5mgを単回経口投与した時、リオシグアトのAUCが健康成人に単独投与したヒストリカルコントロールと比べて約2.6倍に増加した69),70)(外国人データ)。[10.2 参照]
注)本剤の承認された用法及び用量は「通常、成人には1回1錠(ドルテグラビルとして50mg、アバカビルとして600mg及びラミブジンとして300mgを含有)を食事の有無にかかわらず1日1回投与する。」である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 海外第III相臨床試験(SINGLE:ING114467)
抗HIV薬による治療経験のない成人HIV感染症患者833例を対象とした二重盲検比較試験において、ドルテグラビル50mg(1日1回投与)とアバカビル・ラミブジン注1)の併用投与群(ドルテグラビル投与群)に414例、エファビレンツ・テノホビル・エムトリシタビン注2)投与群(対照群)に419例が無作為に割り付けられた。その結果、主要評価項目である投与48週後のHIV-1 RNA量が50copies/mL未満であった患者の割合は、対照群の81%に対して、ドルテグラビル投与群では88%であった。ウイルス学的な治療失敗は、ドルテグラビル投与群の5%及び対照群の6%で認められた。また、投与96週後のHIV-1 RNA量が50copies/mL未満であった患者の割合は、対照群の72%に対して、ドルテグラビル投与群では80%であった。ウイルス学的な治療失敗は、ドルテグラビル投与群の7%及び対照群の8%で認められた。さらに、投与96週後以降に非盲検下で継続投与を行った結果、144週後のHIV-1 RNA量が50copies/mL未満であった患者の割合は、ドルテグラビル投与群では71%、対照群では63%であった。ウイルス学的な治療失敗は、ドルテグラビル投与群の10%及び対照群の7%で認められた47)。
副作用発現頻度は、ドルテグラビル投与群で43%(180/414例)であった。主な副作用は、悪心10%(42/414例)、不眠10%(41/414例)及び浮動性めまい7%(28/414例)であった(96週時)。
なお、本試験における試験成績の要約を表-1に示した。
| 結果 | ドルテグラビル50mg + アバカビル・ (414例) |
エファビレンツ・ 1日1回 (419例) |
||||
|---|---|---|---|---|---|---|
| 48週 | 96週 | 144週 | 48週 | 96週 | 144週 | |
| HIV-1 RNA量が 50copies/mL未満 |
364例 (88%) |
332例 (80%) |
296例 (71%) |
338例 (81%) |
303例 (72%) |
265例 (63%) |
| 両群間の差注3) (95%信頼区間) |
7.4% (2.5%,12.3%) |
8.0% (2.3%,13.8%) |
8.3% (2.0%,14.6%) |
- | ||
| ウイルス学的な 治療失敗注4) |
21例 (5%) |
31例 (7%) |
43例 (10%) |
26例 (6%) |
33例 (8%) |
30例 (7%) |
- 注1)アバカビル600mg・ラミブジン300mgをエプジコム配合錠として1日1回投与
- 注2)エファビレンツ600mg、テノホビルジソプロキシルフマル酸塩300mg、エムトリシタビン200mgをAtripla配合錠として1日1回投与
- 注3)ベースラインの層別因子により調整
- 注4)ウイルス学的効果が不十分のため、投与48週、96週又は144週後までに試験薬剤の投与を中止した症例、若しくは48週、96週又は144週目にHIV-1 RNA量が50copies/mL以上であった症例
17.1.2 海外第III相臨床試験(SPRING-2:ING113086)
抗HIV薬による治療経験のない成人HIV感染症患者822例を対象とした二重盲検比較試験において、ドルテグラビル50mgを1日1回投与した群(ドルテグラビル投与群)と、ラルテグラビル400mgを1日2回投与した群(ラルテグラビル投与群)に、それぞれ411例の患者が無作為に割り付けられた。このうちドルテグラビル投与群の169例及びラルテグラビル群の164例に、背景療法としてアバカビル・ラミブジン注1)が併用投与された。その結果、アバカビル・ラミブジンが併用投与された患者において、主要評価項目である投与48週後のHIV-1 RNA量が50copies/mL未満であった患者の割合は、ドルテグラビル投与群では86%、ラルテグラビル投与群では87%であった。治験実施計画書で定義されたウイルス学的な治療失敗は、ドルテグラビル投与群の4%及びラルテグラビル投与群の5%で認められた。また、投与96週後のHIV-1 RNA量が50copies/mL未満であった患者の割合は、ドルテグラビル投与群では74%、ラルテグラビル投与群では76%であった。治験実施計画書で定義されたウイルス学的な治療失敗は、ドルテグラビル投与群及びラルテグラビル投与群の各5%で認められた48)。
副作用発現頻度は、ドルテグラビル投与群で30%(124/411例)であった。主な副作用は、悪心10%(40/411例)及び頭痛5%(19/411例)であった(96週時)。
なお、本試験における試験成績の要約を表-2に示した。
| 結果 | ドルテグラビル50mg + アバカビル・ (169例) |
ラルテグラビル400mg + アバカビル・ (164例) |
||
|---|---|---|---|---|
| 48週 | 96週 | 48週 | 96週 | |
| HIV-1 RNA量が 50copies/mL未満 |
145例 (86%) |
125例 (74%) |
142例 (87%) |
124例 (76%) |
| 両群間の差(未調整) (95%信頼区間) |
-0.8% (-8.2%,6.6%) |
-1.6% (-11.0%,7.7%) |
- | |
| 治験実施計画書で定義された ウイルス学的な治療失敗注2) |
7例 (4%) |
9例 (5%) |
8例 (5%) |
8例 (5%) |
注1)アバカビル600mg・ラミブジン300mgをエプジコム配合錠として1日1回投与
注2)投与24週後以降の検査において2回連続してHIV-1 RNA量が50copies/mL以上であった症例
17.1.3 海外第IIIb相臨床試験(FLAMINGO:ING114915)
抗HIV薬による治療経験のない成人HIV感染症患者485例を対象とした非盲検比較試験において、ドルテグラビル50mgを1日1回投与した群(ドルテグラビル投与群)に243例、ダルナビル800mg+リトナビル100mgを1日1回投与した群(対照群)に242例が無作為に割り付けられた。このうち484例が有効性・安全性解析対象となり、ドルテグラビル投与群の79例及び対照群の80例に、背景療法としてアバカビル・ラミブジン注1)が併用投与された。その結果、アバカビル・ラミブジンが併用投与された患者において、主要評価項目である投与48週後のHIV-1 RNA量が50copies/mL未満であった患者の割合は、対照群の85%に対して、ドルテグラビル投与群では90%であった。治験実施計画書で定義されたウイルス学的な治療失敗は、対照群の3%で認められたが、ドルテグラビル投与群では認められなかった。また、投与96週後のHIV-1 RNA量が50copies/mL未満であった患者の割合は、対照群の75%に対して、ドルテグラビル投与群では82%であった。治験実施計画書で定義されたウイルス学的な治療失敗は、対照群の4%で認められたが、ドルテグラビル投与群では認められなかった49)。
副作用発現頻度は、ドルテグラビル投与群で33%(80/242例)であった。主な副作用は、悪心12%(29/242例)、下痢9%(21/242例)及び頭痛7%(17/242例)であった(96週時)。
なお、本試験における試験成績の要約を表-3に示した。
| 結果 | ドルテグラビル50mg + アバカビル・ (79例) |
ダルナビル800mg+ 1日1回 + アバカビル・ (80例) |
||
|---|---|---|---|---|
| 48週 | 96週 | 48週 | 96週 | |
| HIV-1 RNA量が 50copies/mL未満 |
71例 (90%) |
65例 (82%) |
68例 (85%) |
60例 (75%) |
| 両群間の差(未調整) (95%信頼区間) |
4.9% (-5.4%,15.1%) |
7.3% (-5.4%,20.0%) |
- | |
| 治験実施計画書で定義された ウイルス学的な治療失敗注2) |
0例 (0%) |
0例 (0%) |
2例 (3%) |
3例 (4%) |
注1)アバカビル600mg・ラミブジン300mgをエプジコム配合錠として1日1回投与
注2)投与24週後以降の検査において2回連続してHIV-1 RNA量が200copies/mLを上回った症例
17.1.4 海外第III相試験(SAILING:ING111762)
抗HIV薬による治療経験があり、かつINSTIの投与経験のない成人HIV感染症患者715例を対象とした二重盲検比較試験において、背景療法とドルテグラビル50mg 1日1回投与を併用した群(ドルテグラビル投与群)と、背景療法とラルテグラビル400mg 1日2回投与を併用した群(ラルテグラビル投与群)に、それぞれ354例及び361例の患者が無作為に割り付けられた。その結果、主要評価項目である投与48週後のHIV-1 RNA量が50copies/mL未満であった患者の割合は、ラルテグラビル投与群の64%に対して、ドルテグラビル投与群は71%であり、群間差(95%信頼区間)は、7.4%(0.7%, 14.2%)であり、ラルテグラビルに対するドルテグラビルの非劣性が示された(非劣性マージン12%)50)。
副作用発現頻度は、ドルテグラビル投与群で20%(73/357例)であった。主な副作用は、下痢8%(29/357例)及び悪心4%(13/357例)であった。
なお、本試験における試験成績の要約を表-4に示した。
| 結果 | ドルテグラビル50mg + 背景療法注1) (354例)注2) |
ラルテグラビル400mg + 背景療法 (361例)注2) |
|---|---|---|
| HIV-1 RNA量が 50copies/mL未満 |
251例 (71%) |
230例 (64%) |
| 両群間の差注3) (95%信頼区間) |
7.4% (0.7%,14.2%) |
|
| ウイルス学的な 治療失敗 |
71例 (20%) |
100例 (28%) |
注1)アバカビル600mg・ラミブジン300mg(エプジコム配合錠)併用は8例、そのうち1例はマラビロクも併用
注2)1実施施設において、データ整合性のため4例が有効性解析から除外
注3)ベースラインの層別因子により調整
17.1.5 海外第IIIb相臨床試験(STRIIVING:201147)
プロテアーゼ阻害剤、INSTI又は非ヌクレオシド系逆転写酵素阻害剤(NNRTI)+NRTI2剤の抗HIV薬による治療によりウイルス学的抑制が得られている成人HIV感染症患者533例を対象とした無作為化非盲検試験において、本剤1日1回投与群(本剤群)又は組入れ時の抗HIV薬による治療を24週間継続する群(治療継続群)にそれぞれ262例及び271例が割り付けられた。主要評価項目である投与後24週時におけるHIV-1 RNA量が50 copies/mL未満の被験者の割合は、表-5のとおりであり、両群間の差の95%信頼区間の下限値が事前に設定された非劣性マージン(-10%)を上回ったことから、治療継続群に対する本剤の非劣性が検証された。
なお、本剤群で投与48週後のHIV-1 RNA量が50copies/mL未満であった被験者の割合は80%であった。
副作用発現頻度は、本剤群で22%(57/262例)であった。主な副作用は悪心8%(20/262例)、疲労3%(9/262例)、下痢3%(9/262例)及び頭痛3%(7/262例)であった(48週時)。
| 結果 | 本剤群注1) (262例) |
治療継続群注2) (271例) |
|---|---|---|
| HIV-1 RNA量が 50copies/mL未満 |
221例 (84%) |
238例 (88%) |
| 両群間の差(調整済み)注3) (95%信頼区間) |
-3.5%(-9.4%,2.5%) | |
| ウイルス学的な治療失敗注4) | 3例 (1%) |
4例 (1%) |
注1)本剤1日1回投与
注2)プロテアーゼ阻害剤、INSTI又はNNRTI+NRTI2剤の継続
注3)ベースラインの層別因子(プロテアーゼ阻害剤、INSTI又はNNRTI)を層としたMantel Haenszel法により調整
注4)投与後24週時でHIV-1 RNA量が50copies/mL以上の被験者数
18. 薬効薬理
18.1 作用機序
18.1.1 ドルテグラビル
ドルテグラビルはレトロウイルスの複製に必要な酵素であるHIVインテグラーゼの活性部位に結合することによってその活性を阻害し、ウイルスDNAの宿主DNAへの組込みを抑制する。
18.1.2 アバカビル
アバカビルは細胞内で活性化型のカルボビル三リン酸に変換される。カルボビル三リン酸は天然基質デオキシグアノシン三リン酸に代わってウイルスDNA鎖に取りまれ、DNA鎖の伸長を停止させることによりHIVの複製を阻害する。また、カルボビル三リン酸はHIV逆転写酵素を競合的に阻害する51),52),53)。
18.1.3 ラミブジン
ラミブジンは細胞内でリン酸化され、HIVを感染させた細胞内での半減期が約12時間の活性化型の三リン酸化体に変換される54)。ラミブジン三リン酸化体はHIVの逆転写酵素によりデオキシシチジン三リン酸の代わりにウイルスDNA鎖に取り込まれ、DNA鎖の伸長を停止させることによりHIVの複製を阻害する55)。また、ラミブジン三リン酸化体はHIVの逆転写酵素を競合的に阻害する55)。一方、in vitroで、ヒト末梢血リンパ球、リンパ球系・単球-マクロファージ系の株化細胞56)及び種々のヒト骨髄前駆細胞に対するラミブジンの細胞毒性は弱かった。18.2 抗ウイルス作用
18.2.1 ドルテグラビル
HIV-1 BaL株及びHIV-1 NL432株に感染させた末梢血単核球を用いた時のドルテグラビルのウイルス複製に対する50%阻害濃度(IC50)は、それぞれ0.51及び0.53nMであり、HIV-1 IIIB株に感染させたMT-4細胞を用いた時のIC50は2.1nMであった(in vitro)。
13種のHIV-1臨床分離株(サブタイプB)のインテグラーゼコード領域を導入した組換えウイルスに対するドルテグラビルのIC50(平均値)は0.52nMであり、その活性は実験室株に対する抗ウイルス活性と同程度であった。24種のHIV-1臨床分離株[グループM(サブタイプA、B、C、D、E、F、G)及びグループO]並びに3種のHIV-2臨床分離株からなるパネル株を感染させた末梢血単核球を用いた時のドルテグラビルのIC50(幾何平均)はHIV-1株及びHIV-2株でそれぞれ0.20nM(範囲は0.02~2.14nM)及び0.18nM(範囲は0.09~0.61nM)であった(in vitro)。
18.2.2 アバカビル
アバカビルのHIV-1に対するIC50はHIV-1 IIIB株に対して3.7~5.8μM、臨床分離株に対して0.26±0.18μM(8例)、HIV-1 BaL株に対して0.07~1.0μMであった。また、HIV-2に対するIC50はHIV-2(Zy)株に対して4.1μM、HIV-2 LAV-2株に対して7.5μMであった。In vitroでNRTIのジダノシン、エムトリシタビン、ラミブジン、サニルブジン、テノホビル、ザルシタビン及びジドブジン、NNRTIのネビラピン、及びプロテアーゼ阻害剤のアンプレナビルとの相加又は相乗作用が認められた52)。また、ヒト末梢血単核球から活性化リンパ球を除いた場合に、より強い抗HIV作用を示したことから、アバカビルは静止細胞でより強く抗ウイルス作用を示すものと考えられる57)。
18.2.3 ラミブジン
In vitroでのラミブジンのHIV-1(RF、GB8、U455及びIIIB株)に対するIC50は670nM以下、HIV-2 ROD株に対するIC50は40nMであった56)。
In vitroでアバカビル、ジダノシン、ネビラピン、ザルシタビン及びジドブジンとの相加又は相乗作用が認められた67)。また、in vitroにおいて、ラミブジンは単独で、ジドブジン耐性臨床分離株の平均p24抗原量を薬物無処置群に比べ66~80%低下させた。
In vitroでの26種のHIV-1臨床分離株[グループM(サブタイプA、B、C、D、E、F、G)]並びに3種類のHIV-2臨床分離株に対するラミブジンのIC50(平均値)はHIV-1株及びHIV-2株でそれぞれ40nM(範囲は1~120nM)及び42nM(範囲は2~120nM)であった。
18.3 薬剤耐性
18.3.1 ドルテグラビル
抗HIV薬による治療経験があり、かつINSTIの投与経験のない患者を対象としたSAILING試験(ドルテグラビル投与群354例)において、投与48週後にウイルス学的な治療失敗例の17例中4例でINSTIに耐性が認められた。これら4例中2例に特有のR263Kインテグラーゼ変異が認められ、FCの最大値は1.93であった。もう1例には、多型のV151V/Iインテグラーゼ変異が認められFCの最大値は0.92であり、残り1例には試験前からインテグラーゼ変異の存在が認められており、既にINSTIの投与経験があるか、又はインテグラーゼ耐性ウイルスに感染したものと推定された。
HIV-1 IIIB株及びHIV-1 NL432株をそれぞれ112及び56日間継代培養した試験でみられたインテグラーゼ領域のアミノ酸変異はS153Y、S153F、E92Q及びG193Eであり、FC(各種分離株に対するIC50/野生型HIV-1株に対するIC50)の最大値は4.1であった。また、HIV-1臨床分離株(サブタイプB、C及びA/G)を更に長期間継代培養した試験でみられた変異はG118R(FC=10)、S153T及びR263K(FC=1.5)であった(in vitro)。
18.3.2 アバカビル
アバカビルに対して低感受性のHIV-1分離株がin vitro及びアバカビル投与患者から分離されており、いずれも逆転写酵素にM184V、K65R、L74V及びY115Fの変異が確認された。これらの変異を2種以上含むことにより、アバカビル感受性は1/10に低下した。臨床分離株ではM184V及びL74Vの変異が頻回に観察された53)。
18.3.3 ラミブジン
ラミブジンを含む抗HIV薬で治療を受けたHIV-1感染症患者で発現するラミブジン耐性HIV-1には、HIV逆転写酵素の活性部位に近い184番目のアミノ酸のメチオニンからバリンへの変異(M184V)がみられる58)。このM184V変異の結果、ウイルスのラミブジンに対する感受性は著明に低下し58),59)、in vitroでのウイルスの複製能力は低下する60)。
In vitroにおいて、ジドブジン耐性臨床分離株にラミブジン耐性変異を導入すると、ジドブジンに対する感受性は回復することが確認されている。また、抗HIV薬の治療経験のない患者にジドブジン及びラミブジンを併用することにより、ジドブジン耐性ウイルスの出現が遅延する61)。さらに、抗HIV薬(ラミブジンを含む)の多剤併用療法はM184V変異ウイルスを有する患者と同様、抗HIV薬の治療経験のない患者においても有効性が確認されている62),63)。
18.4 交差耐性
18.4.1 ドルテグラビル
ラルテグラビル[Fold Change(FC)>81]に対する遺伝子型及び表現型の耐性を有する30種の臨床分離株について、ドルテグラビル(FC=1.5)に対する感受性を調べた。G140S+Q148H分離株では、ドルテグラビルのFC値は3.75であり、G140S+Q148R分離株では13.3、T97A+Y143R分離株では1.05、N155H分離株では1.37であった。ラルテグラビルの投与経験のある患者から分離した705種のラルテグラビル耐性株について、ドルテグラビルに対する感受性を調べたところ、93.9%の分離株に対してFCが10以下であった(in vitro)。
部位特異的変異を有する60種のINSTI耐性HIV-1ウイルスパネル株(28種は単一アミノ酸変異、32種は二重又は多重変異)を用いてドルテグラビルの抗ウイルス活性を検討した。単一のINSTI耐性変異(T66K、I151L及びS153Y)を有するウイルスでは、ドルテグラビルに対する感受性が2倍以上(2.3~3.6倍)低下した。複数の変異(T66K/L74M、E92Q/N155H、G140C/Q148R、G140S/Q148H、G140S/Q148R、G140S/Q148K、Q148R/N155H、T97A/G140S/Q148及びE138/G140/Q148)を有するウイルスでは、ドルテグラビルに対する感受性が2倍以上(2.5~21倍)低下した(in vitro)。INSTIに耐性を有する患者を対象としたVIKING-3試験では、投与24週後までに183例中36例でウイルス学的な治療失敗が認められた。このうち31例については、試験開始時及びウイルス学的な治療失敗時の両時点で解析用耐性データがあり、31例中16例(52%)で投与に伴う変異が認められた。確認された治療下での変異又は混合変異はL74L/M(1例)、E92Q(2例)、T97A(8例)、E138K/A(7例)、G140S(2例)、Y143H(1例)、S147G(1例)、Q148H/K/R(4例)、N155H(1例)及びE157E/Q(1例)であった。また、治療下で変異の出現が認められた16例中14例において、試験開始時又はそれ以前からQ148の変異を有していた。
18.4.2 アバカビル
2種以上のアバカビル関連耐性変異を獲得したHIV-1株のうち数種は、in vitroでラミブジン、ジダノシン及びザルシタビンに対して交差耐性を示し、一方、ジドブジン及びサニルブジンには感受性を示した53)。
アバカビルとHIVプロテアーゼ阻害剤とは標的酵素が異なることから、両者間で交差耐性を示す可能性は低く、NNRTIも逆転写酵素の結合部位が異なることから、交差耐性を示す可能性は低いものと考えられる。
18.4.3 ラミブジン
ジドブジン及びサニルブジンは、ラミブジン耐性HIV-1に対し抗ウイルス活性を維持する59),61),64)。
アバカビルはM184V変異のみが認められているウイルスに対しては、抗ウイルス活性を維持する53)。
また、ジダノシン及びザルシタビンは、M184V変異ウイルスに対して感受性が低下するというin vitroでの報告があるが、これらの感受性の低下と臨床効果の関係は明らかにされていない65)。
19. 有効成分に関する理化学的知見
| 一般的名称 | ドルテグラビルナトリウム(Dolutegravir Sodium) |
|---|---|
| 化学名 | Monosodium(4R,12aS)-9-{[(2,4-difluorophenyl)methyl]carbamoyl}-4-methyl-6,8-dioxo-3,4,6,8,12,12a-hexahydro-2H-pyrido[1',2':4,5]pyrazino[2,1-b][1,3]oxazin-7-olate |
| 分子式 | C20H18F2N3NaO5 |
| 分子量 | 441.36 |
| 性状 | 白色~淡黄白色の粉末である。水に溶けにくく、エタノール(99.5)にほとんど溶けない。 |
| 化学構造式 | 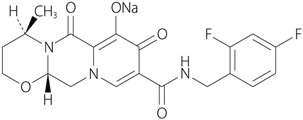 |
| 融点 | 1型結晶は約350℃で溶解と同時に分解する。 |
| 分配係数 |
2.16±0.01(23℃) |
| 一般的名称 | アバカビル硫酸塩(Abacavir Sulfate) |
|---|---|
| 化学名 | {(1S,4R)-4-[2-amino-6-(cyclopropylamino)purin-9-yl]cyclopenta-2-enyl}methanol hemisulfate |
| 分子式 | (C14H18N6O)2・H2SO4 |
| 分子量 | 670.74 |
| 性状 | 白色~微黄白色の粉末である。トリフルオロ酢酸に溶けやすく、水にやや溶けやすく、メタノール及びエタノール(95)に溶けにくい。0.1mol/L塩酸試液及び希水酸化ナトリウム試液に溶ける。 |
| 化学構造式 | 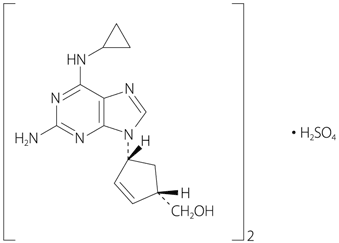 |
| 融点 | 約219℃(分解) |
| 分配係数 |
1.20(pH7.1~7.3、1-オクタノール/水) |
| 一般的名称 | ラミブジン(Lamivudine) |
|---|---|
| 化学名 | 1-[(2R,5S)-2-hydroxymethyl-1,3-oxathiolan-5-yl]cytosine |
| 分子式 | C8H11N3O3S |
| 分子量 | 229.26 |
| 性状 | 白色~微黄白色の結晶性の粉末である。ジメチルスルホキシドに溶けやすく、水にやや溶けやすく、メタノール又はエタノール(99.5)にやや溶けにくく、ジエチルエーテルにほとんど溶けない。 |
| 化学構造式 | 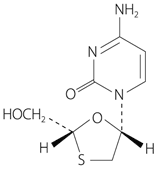 |
| 融点 | 約176℃ |
| 分配係数(logP) | -0.9(1-オクタノール/水系) |
21. 承認条件
21.1
医薬品リスク管理計画を策定の上、適切に実施すること。
21.2
本剤を使用する場合は重篤な過敏症に留意し、過敏症の兆候又は症状が発現した場合には本剤の使用を中止する等の適切な処置をとるよう、医師に要請すること。
21.3
本剤の使用に当たっては、患者に対して本剤に関して更なる有効性・安全性のデータを引き続き収集中であること等を十分に説明し、インフォームドコンセントを得るよう、医師に要請すること。
21.4
海外において現在実施中又は計画中の臨床試験については、終了後速やかに試験成績及び解析結果を提出すること。
21.5
再審査期間が終了するまでの間、原則として国内の全投与症例を対象とした製造販売後調査を実施し、本剤の使用実態に関する情報(患者背景、有効性・安全性(他剤併用時の有効性・安全性を含む。)及び薬物相互作用のデータ等)を収集して定期的に報告するとともに、調査の結果を再審査申請時に提出すること。
22. 包装
30錠[瓶、バラ、乾燥剤入り]
23. 主要文献
- Zash R, et al.:International AIDS Conference 2022. Poster PELBB02
- Dickinson L, et al.:Clin Infect Dis. 2021;73:e1200-e1207
- Shapiro RL, et al.:Antiviral Therapy. 2013;18:585-590
- Moodley J, et al.:J.Infect.Dis. 1998;178:1327-1333
- Song I, et al.:Antimicrob Agents Chemother.2011;55(7):3517-3521
- Song I, et al.:Eur J Clin Pharmacol.2014;70(10):1173-1179
- Song I, et al.:Antimicrob Agents Chemother.2014;58(11):6696-6700
- 社内資料:薬物相互作用に関する試験(200901)
- Dooley KE, et al.:J Acquir Immune Defic Syndr.2013;62(1):21-27
- Patel P, et al.:J Antimicrob Chemother.2011;66(7):1567-1572
- 社内資料:薬物相互作用に関する試験(201167)
- McDowell JA, et al.:Antimicrob Agents Chemother. 2000;44:1686-1690
- Moltó J, et al.:Antimicrob Agents Chemother. 2016;60(4):2564-2566
- Bollen P, et al.:AIDS. 2016;30:1490-1491
- 社内資料:第I相試験(204662)
- 社内資料:海外第I相試験(ING114580)
- 社内資料:第I相試験(ING115381、テビケイ錠50mg 2014年3月24日承認、CTD 2.7.2.2.1.2.1.)
- 社内資料:海外臨床試験(ING111521)
- 社内資料:海外臨床試験(ING111207、テビケイ錠50mg 2014年3月24日承認、CTD 2.7.2.2.1.1.1.)
- 社内資料:海外臨床試験(ING112276)
- 矢野 邦夫ほか:化学療法の領域. 2008;24:87-98
- Kumar PN, et al.:Antimicrob Agents Chemother. 1999;43:603-608
- McDowell JA, et al.:Antimicrob Agents Chemother. 2000;44:2061-2067
- Pluda JM, et al.:J Infect Dis. 1995;171:1438-1447
- van Leeuwen R, et al.:AIDS. 1992;6:1471-1475
- Chittick GE, et al.:Pharmacotherapy. 1999;19:932-942
- 社内資料:分布に関する試験(2011N119355、テビケイ錠50mg 2014年3月24日承認、CTD 2.4.3.3.3.1.)
- 社内資料:分布に関する試験(RD2008/00361、テビケイ錠50mg 2014年3月24日承認、CTD 2.4.3.3.3.2.)
- 社内資料:分布に関する試験(2011N112380、テビケイ錠50mg 2014年3月24日承認、CTD 2.4.3.3.3.2.)
- McDowell JA, et al.:Antimicrob Agents Chemother. 1999;43:2855-2861
- van Leeuwen R, et al.:J Infect Dis. 1995;171:1166-1171
- 社内資料:代謝に関する試験(RD2008/01339、テビケイ錠50mg 2014年3月24日承認、CTD 2.4.3.3.6.1.)
- 社内資料:代謝に関する試験(RD2008/00373、テビケイ錠50mg 2014年3月24日承認、CTD 2.4.3.3.6.1.)
- 社内資料:代謝に関する試験(RD2000/02310)
- 社内資料:排泄に関する試験(2010N104937、テビケイ錠50mg 2014年3月24日承認、CTD 2.4.3.3.6.2.)
- 社内資料:排泄に関する試験(2013N161621、テビケイ錠50mg 2014年3月24日承認、CTD 2.4.3.3.6.2.)
- エピビル錠 米国添付文書.
- Jung N, et al.:Drug Metab Dispos. 2008;36:1616-1623
- Muller F, et al.:Biochem Pharmacol. 2013;86:808-815
- Weller S, et al.:Eur J Clin Pharmacol.2014;70(1):29-35
- Thompson M, et al.:Abstracts of the 12th World AIDS Conference. 1998;Abstract 42278
- Heald AE, et al.:Antimicrob Agents Chemother. 1996;40:1514-1519
- 社内資料:海外第I相試験(ING113097、テビケイ錠50mg 2014年3月24日承認、CTD 2.7.2.2.1.2.2.)
- Raffi F, et al.:Abstracts of the 40th Interscience Conference on Antimicrobial Agents and Chemotherapy. 2000;Abstract 1630
- Johnson MA, et al.:Eur J Clin Pharmacol. 1998;54:363-366
- 社内資料:海外臨床試験(CNAA1012)
- 社内資料:海外臨床試験(ING114467)
- 社内資料:海外臨床試験(ING113086)
- 社内資料:海外臨床試験(ING114915)
- Cahn P, et al.:Lancet.2013;382(9893):700-708
- Faletto MB, et al.:Antimicrob Agents Chemother. 1997;41:1099-1107
- Daluge SM, et al.:Antimicrob Agents Chemother. 1997;41:1082-1093
- Tisdale M, et al.:Antimicrob Agents Chemother. 1997;41:1094-1098
- Cammack N, et al.:Biochem Pharmacol. 1992;43:2059-2064
- Hart GJ, et al.:Antimicrob Agents Chemother. 1992;36:1688-1694
- Coates JAV, et al.:Antimicrob Agents Chemother. 1992;36:733-739
- Saavedra J, et al.:Abstracts of the 37th Interscience Conference on Antimicrobial Agents and Chemotherapy. 1997;253
- Schuurman R, et al.:J Infect Dis. 1995;171:1411-1419
- Tisdale M, et al.:Proc Natl Acad Sci USA. 1993;90:5653-5656
- Back NKT, et al.:EMBO J. 1996;15:4040-4049
- Larder BA, et al.:Science. 1995;269:696-699
- Maguire M, et al.:AIDS. 2000;14:1195-1201
- Kuritzkes DR, et al.:AIDS. 1996;10:975-981
- Schinazi RF, et al.:Int Antiviral News. 2000;8:65-91
- Miller V, et al.:AIDS. 1998;12:705-712
- Yuen GJ, et al.:Clin Pharmacokinet. 2008;47:351-371
- Merrill DP, et al.:J Infect Dis. 1996; 173: 355-364
- Johnson MA, et al.:Br J Clin Pharmacol. 1998;46:21-27
- Jungmann NA, et al.:Expert Opin Drug Metab Toxicol. 2019;15:975-984
- DeJesus E, et al.:Pulm Circ. 2019;9(2):1-10
**24. 文献請求先及び問い合わせ先
グラクソ・スミスクライン株式会社
東京都港区赤坂1-8-1
ヴィーブヘルスケア・カスタマー・サービス
TEL:0120-066-525(9:00~17:45/土日祝日及び当社休業日を除く)
https://viivhealthcare.com/ja-jp/
26. 製造販売業者等
**26.1 製造販売元
ヴィーブヘルスケア株式会社
東京都港区赤坂1-8-1
**26.2 販売元
グラクソ・スミスクライン株式会社
東京都港区赤坂1-8-1
【その他の説明(付属機器の取り扱い等)】
■過敏症を注意するカード
- (表面)

- (中面)

- (裏面)
