ゲンボイヤ配合錠の添付文書
- 商品名:
- ゲンボイヤ配合錠
- 一般名:
- エルビテグラビル+コビシスタット+テノホビル アラフェナミド+エムトリシタビン(EVG/cobi/TAF/FTC)
- 略称 :
- GEN
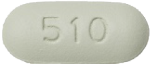
添付文書の読み方
ここで提供している添付文書情報は、2024年3月現在の各医薬品の添付文書を基に作成したものです。書式等については、実際の添付文書と異なるところがあります。添付文書情報は随時更新されます。ご使用の際は、必ず最新の添付文書をご覧下さい。
また、記載されている内容には、専門的な情報が含まれています。文書内の、
この色の文字をクリックすると、別ウィンドウに読み方のアドバイスが表示されます。
この色の文字をクリックすると、別ウィンドウに重大な副作用の解説が表示されます。
この色の文字をクリックすると、別ウィンドウに副作用の症状とその類似語、定義の解説が表示されます。
記載されている情報をご覧になり、疑問などを持たれた場合は、医師・薬剤師にご相談ください。
抗ウイルス化学療法剤
エルビテグラビル+コビシスタット+テノホビル アラフェナミド+エムトリシタビン(EVG/cobi/TAF/FTC)

- **2023年8月改訂(第3版)
- *2021年6月改訂(第2版)
- 劇薬
処方箋医薬品注)
注)注意―医師等の処方箋により使用すること
| 日本標準商品分類番号 | 87625 |
|---|
| 貯法 | 室温保存 |
|---|---|
| 有効期間 | 36箇月 |
| 承認番号 | 23100AMX00302000 |
|---|---|
| 販売開始 | 2019年4月 |
1. 警告
B型慢性肝炎を合併している患者では,本剤の投与中止により,B型慢性肝炎が再燃するおそれがあるので,本剤の投与を中断する場合には十分注意すること。特に非代償性の場合,重症化するおそれがあるので注意すること。[9.1.1 参照]
2. 禁忌(次の患者には投与しないこと)
2.1
本剤の成分に対し過敏症の既往歴のある患者
2.2
次の薬剤を投与中の患者:カルバマゼピン,フェノバルビタール,フェニトイン,ホスフェニトイン,リファンピシン,セイヨウオトギリソウ(St. John’s Wort:セント・ジョーンズ・ワート)含有食品,ジヒドロエルゴタミンメシル酸塩,エルゴタミン酒石酸塩・無水カフェイン・イソプロピルアンチピリン,エルゴメトリンマレイン酸塩,メチルエルゴメトリンマレイン酸塩,アスナプレビル,シンバスタチン,ピモジド,シルデナフィルクエン酸塩(レバチオ),バルデナフィル塩酸塩水和物,タダラフィル(アドシルカ),ブロナンセリン,アゼルニジピン,リバーロキサバン,トリアゾラム,ミダゾラム,ロミタピドメシル酸塩,テラプレビル[10.1 参照]
2.3
腎機能又は肝機能障害がありコルヒチンを投与中の患者[9.2.1 参照],[9.3.1 参照],[10.2 参照]
3. 組成・性状
3.1 組成
| 有効成分 (1錠中) |
エルビテグラビル150mg,コビシスタット150mg,エムトリシタビン200mg及びテノホビル アラフェナミドフマル酸塩11.2mg(テノホビル アラフェナミドとして10mg) |
|---|---|
| 添加剤 | 二酸化ケイ素,クロスカルメロースNa,ヒドロキシプロピルセルロース,乳糖,セルロース,ラウリル硫酸Na,ステアリン酸Mg,ポリビニルアルコール(部分けん化物),青色2号,マクロゴール,三二酸化鉄,酸化チタン,タルク |
| 有効成分 | 1錠中 エルビテグラビル 150mg |
|---|---|
| 1錠中 コビシスタット 150mg |
|
| 1錠中 エムトリシタビン 200mg |
|
| 1錠中 テノホビル アラフェナミドフマル酸塩 11.2mg (テノホビル アラフェナミドとして 10mg) |
|
| 添加剤 | 二酸化ケイ素,クロスカルメロースNa,ヒドロキシプロピルセルロース,乳糖,セルロース,ラウリル硫酸Na,ステアリン酸Mg,ポリビニルアルコール(部分けん化物),青色2号,マクロゴール,三二酸化鉄,酸化チタン,タルク |
3.2 製剤の性状
| 剤形 | フィルムコーティング錠 | |
|---|---|---|
| 色調 | 緑色 | |
| 外形 | 表面 |  |
| 裏面 |  |
|
| 側面 |  |
|
| 大きさ | 長径 | 約19.2mm |
| 短径 | 約8.7mm | |
| 質量 | 約1,080mg | |
| 識別コード | GSI-510 | |
4. 効能又は効果
HIV-1感染症
5. 効能又は効果に関連する注意
5.1
以下のいずれかのHIV-1感染症患者に使用すること。
5.1.1
抗HIV薬による治療経験がない患者
5.1.2
ウイルス学的失敗の経験がなく,切り替え前6ヵ月間以上においてウイルス学的抑制(HIV-1 RNA量が50copies/mL未満)が得られており,エルビテグラビル,エムトリシタビン又はテノホビルに対する耐性関連変異を持たず,本剤への切り替えが適切であると判断される抗HIV薬既治療患者
5.2
本剤による治療にあたっては,患者の治療歴及び可能な場合には薬剤耐性検査(遺伝子型解析あるいは表現型解析)を参考にすること。
6. 用法及び用量
通常,成人及び体重25kg以上の小児には,1回1錠(エルビテグラビルとして150mg,コビシスタットとして150mg,エムトリシタビンとして200mg及びテノホビル アラフェナミドとして10mgを含有)を1日1回食後に経口投与する。
7. 用法及び用量に関連する注意
7.1
本剤は,HIV-1感染症に対して1剤で治療を行うものであるため,他の抗HIV薬と併用しないこと。
7.2
本剤はエルビテグラビル,コビシスタット,エムトリシタビン及びテノホビル アラフェナミドフマル酸塩の4成分を含有した配合錠である。これらの成分を含む製剤と併用しないこと。また,テノホビル ジソプロキシルフマル酸塩を含む製剤についても併用しないこと。
7.3
コビシスタットと類似の薬理作用を有しているリトナビルを含む製剤,及びエムトリシタビンと類似の薬剤耐性,ウイルス学的特性を有しているラミブジンを含む製剤と併用しないこと。
7.4
本剤投与後,クレアチニンクリアランスが30mL/min未満に低下した場合は,投与の中止を考慮すること。[8.3 参照],[9.2.2 参照],[10.2 参照],[11.1.1 参照],[15.1 参照],[16.6.1 参照]
8. 重要な基本的注意
**,*8.1
本剤の使用に際しては,国内外のガイドライン等の最新の情報を参考に,患者又はそれに代わる適切な者に次の事項についてよく説明し同意を得た後,使用すること。
8.1.1
本剤はHIV感染症の根治療法薬ではないことから,日和見感染症を含むHIV感染症の進展に伴う疾病を発症し続ける可能性があるので,本剤投与開始後の身体状況の変化についてはすべて担当医に報告すること。
8.1.2
本剤の長期投与による影響については現在のところ不明であること。
8.1.3
担当医の指示なしに用量を変更したり,服用を中止したりしないこと。
8.1.4
本剤は併用薬剤と相互作用を起こすことがあるため,服用中のすべての薬剤を担当医に報告すること。また,本剤で治療中に新たに他の薬剤を服用する場合,事前に担当医に相談すること。
8.2
抗HIV薬の多剤併用療法を行った患者で,免疫再構築炎症反応症候群が報告されている。投与開始後,免疫機能が回復し,症候性のみならず無症候性日和見感染(マイコバクテリウムアビウムコンプレックス,サイトメガロウイルス,ニューモシスチス等によるもの)等に対する炎症反応が発現することがある。また,免疫機能の回復に伴い自己免疫疾患(甲状腺機能亢進症,多発性筋炎,ギラン・バレー症候群,ブドウ膜炎等)が発現するとの報告があるので,これらの症状を評価し,必要時には適切な治療を考慮すること。
8.3
本剤投与前にクレアチニンクリアランス,尿糖及び尿蛋白の検査を実施すること。クレアチニンクリアランスが30mL/min以上であることを確認すること。また,本剤投与後も定期的な検査等により患者の状態を注意深く観察すること。[7.4 参照],[9.2.2 参照],[10.2 参照],[11.1.1 参照],[15.1 参照],[16.6.1 参照]
8.4
アジア系人種におけるエムトリシタビンの薬物動態は十分に検討されていないが,少数例の健康成人及びB型慢性肝炎のアジア系人種において,Cmaxの上昇を示唆する成績が得られているので,HBV感染症合併患者を含め,副作用の発現に注意すること。
8.5
エムトリシタビン製剤の臨床試験において皮膚変色が発現し,その発現頻度は有色人種で高いことが示唆されている。その原因は現在のところ不明である。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 B型肝炎ウイルス感染を合併している患者
本剤の投与を中断する場合には十分注意すること。B型慢性肝炎を合併している患者では,本剤の投与中止により,B型慢性肝炎が再燃するおそれがある。特に非代償性の場合,重症化するおそれがある。[1. 参照]
9.1.2 腎機能障害のリスクを有する患者
血清リンの検査を実施すること。
9.1.3 病的骨折の既往のある患者又はその他の慢性骨疾患を有する患者
十分な観察を行い,異常が認められた場合には,投与を中止する等,適切な処置を行うこと。非臨床試験及び臨床試験において,骨密度の低下と骨代謝の生化学マーカーの上昇が認められ,骨代謝の亢進が示唆された。また,抗HIV薬による治療経験がないHIV-1感染症患者を対象とした第III相臨床試験において,骨密度が低下した症例が認められた。
9.2 腎機能障害患者
9.2.1 腎機能障害がありコルヒチンを投与中の患者
投与しないこと。コルヒチンの血中濃度が上昇する可能性がある。[2.3 参照],[10.2 参照]
9.2.2 重度の腎機能障害のある患者(コルヒチンを投与中の患者を除く)
エムトリシタビンの血中濃度が上昇する。[7.4 参照],[8.3 参照],[10.2 参照],[11.1.1 参照],[15.1 参照],[16.6.1 参照]
9.3 肝機能障害患者
9.3.1 肝機能障害がありコルヒチンを投与中の患者
投与しないこと。コルヒチンの血中濃度が上昇する可能性がある。[2.3 参照],[10.2 参照]
9.3.2 重度の肝機能障害のある患者(コルヒチンを投与中の患者を除く)
エルビテグラビルの血中濃度が上昇する可能性がある。[16.6.2 参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には,投与しないことが望ましい。本剤投与中に妊娠が判明した場合の代替薬への変更は,変更によるリスクを考慮した上で適切な時期に実施すること。妊娠中期及び妊娠後期の妊婦に本剤を投与したとき,出産後と比較しエルビテグラビル及びコビシスタットの血中濃度低下が認められている。[16.6.3 参照]動物試験(サル)においてテノホビルの胎児への移行が報告されている1)。
9.6 授乳婦
授乳を避けさせること。テノホビル及びエムトリシタビンのヒト乳汁への移行が報告されている2)。なお,エルビテグラビル,コビシスタット及びテノホビル アラフェナミドのヒト乳汁への移行は不明である。動物実験(ラット)においてエルビテグラビル及びコビシスタットの乳汁への移行が報告されている。また,女性のHIV感染症患者は,乳児のHIV感染を避けるため,乳児に母乳を与えないことが望ましい。
9.7 小児等
低出生体重児,新生児,乳児,幼児又は体重25kg未満の小児を対象とした臨床試験は実施していない。[16.1.3 参照]
9.8 高齢者
患者の肝,腎及び心機能の低下,合併症,併用薬等を十分に考慮すること。
10. 相互作用
エルビテグラビル:CYP3Aで代謝される3)。[16.7.1 参照]
コビシスタット:CYP3A及び一部がCYP2D6で代謝され,CYP3A及びCYP2D6を阻害する4)。また,OCT2の基質であり5),P-gpを阻害する6)。[16.7.1 参照]
テノホビル及びエムトリシタビン:糸球体ろ過と能動的な尿細管分泌により腎排泄される7),8)。[16.7.1 参照]
テノホビル アラフェナミド:カテプシンA9),10),CYP3A11)及びP-gp12)の基質である。[16.7.1 参照]
10.1 併用禁忌(併用しないこと)
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
|
エルビテグラビル及びコビシスタットの血中濃度が著しく低下する可能性がある。また,テノホビル アラフェナミドの血中濃度が低下する可能性がある。 | これら薬剤のCYP3A及びP-gpの誘導作用によるため。 |
|
これら薬剤の血中濃度が上昇し,重篤な又は生命に危険を及ぼすような事象(末梢血管攣縮,四肢及びその他組織の虚血等)が起こる可能性がある。 | コビシスタットのCYP3A阻害作用によるため。 |
| アスナプレビル (スンベプラ) [2.2 参照] |
アスナプレビルの血中濃度が上昇し,肝臓に関連した有害事象が発現し,また,重症化する可能性がある。 | コビシスタットのCYP3A阻害作用によるため。 |
| シンバスタチン (リポバス) [2.2 参照] |
シンバスタチンの血中濃度が上昇し,重篤な有害事象(横紋筋融解症を含むミオパチー等)が起こる可能性がある。 | コビシスタットのCYP3A阻害作用によるため。 |
| ピモジド (オーラップ) [2.2 参照] |
ピモジドの血中濃度が上昇し,重篤な又は生命に危険を及ぼすような事象(不整脈等)が起こる可能性がある。 | コビシスタットのCYP3A阻害作用によるため。 |
|
これら薬剤の血中濃度が上昇し,視覚障害,低血圧,持続勃起及び失神等の有害事象が起こる可能性がある。 | コビシスタットのCYP3A阻害作用によるため。 |
|
これら薬剤の血中濃度が上昇し,重篤な又は生命に危険を及ぼすような事象が起こる可能性がある。 | コビシスタットのCYP3A阻害作用によるため。 |
|
これら薬剤の血中濃度が上昇し,重篤な又は生命に危険を及ぼすような事象(鎮静作用の延長や増強又は呼吸抑制等)が起こる可能性がある。 | コビシスタットのCYP3A阻害作用によるため。 |
| ロミタピドメシル酸塩 (ジャクスタピッド) [2.2 参照] |
ロミタピドの血中濃度が著しく上昇する可能性がある。 | コビシスタットのCYP3A阻害作用によるため。 |
| テラプレビル (テラビック) [2.2 参照] |
テノホビル アラフェナミドの抗HIV-1活性が低下するため,本剤の効果が減弱する可能性がある。 | テラプレビルのカテプシンA活性阻害作用によるため。 |
** 10.2 併用注意(併用に注意すること)
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
|
これら薬剤の血中濃度が上昇する可能性がある。本剤と併用する場合は,これら薬剤の血中濃度をモニタリングすることが望ましい。 | コビシスタットのCYP3A阻害作用によるため。 |
|
これら薬剤の血中濃度が上昇する可能性がある。本剤と併用する場合は,これら薬剤の血中濃度をモニタリングすることが望ましい。 | コビシスタットのCYP3A阻害作用によるため。 |
|
これら薬剤の血中濃度が上昇する可能性がある。本剤と併用する場合は,患者の状態を注意して観察することが望ましい。 | コビシスタットのCYP3A阻害作用によるため。 |
|
これら薬剤の血中濃度が上昇する可能性がある。本剤と併用する場合は,患者の状態を注意して観察することが望ましい。 | コビシスタットのCYP3A阻害作用によるため。 |
|
これら薬剤の血中濃度が上昇する可能性がある。本剤と併用時にこれら薬剤を増量する場合は慎重に行い,患者の状態を注意して観察することが望ましい。 | コビシスタットのCYP3A阻害作用によるため。 |
| コルヒチン [2.3 参照],[9.2.1 参照],[9.3.1 参照] |
コルヒチンの血中濃度が上昇する可能性がある。 | コビシスタットのCYP3A阻害作用によるため。 |
| アトルバスタチンカルシウム水和物 [16.7.2 参照] |
アトルバスタチンの血中濃度が上昇する可能性がある。アトルバスタチンカルシウム水和物と併用する場合は,最少量から投与し,安全性を観察しながら増量すること。 | コビシスタットのCYP3A阻害作用によるため。 |
| サルメテロールキシナホ酸塩 | サルメテロールの血中濃度が上昇し,QT延長,動悸及び洞性頻脈等の心血管系有害事象の発現リスクが上昇する可能性がある。 | コビシスタットのCYP3A阻害作用によるため。 |
|
これら薬剤の血中濃度が上昇し,低血圧,失神,視覚障害及び持続勃起等の有害事象が増加する可能性がある。 | コビシスタットのCYP3A阻害作用によるため。 |
|
これら薬剤の血中濃度が上昇する可能性がある。本剤と併用する場合は,これら薬剤の減量を考慮すること。また,患者の状態を注意して観察することが望ましい。 | コビシスタットのCYP3A阻害作用によるため。 |
| ボセンタン水和物 | ボセンタン水和物の血中濃度が上昇する可能性がある。本剤と併用する場合は,ボセンタン水和物の減量を考慮すること。 | コビシスタットのCYP3A阻害作用によるため。 |
|
これら薬剤の血中濃度が上昇する可能性がある。 | コビシスタットのCYP3A阻害作用によるため。 |
| **フルチカゾン | フルチカゾンの血中濃度が上昇し,内因性の血清コルチゾール濃度が低下する可能性がある。特に長期間併用する場合は,他剤への変更を考慮すること。 | コビシスタットのCYP3A阻害作用によるため。 |
| デキサメタゾン | エルビテグラビル及びコビシスタットの血中濃度が著しく低下する可能性がある。 | デキサメタゾンのCYP3A誘導作用によるため。 |
| クラリスロマイシン | クラリスロマイシン及びコビシスタットの血中濃度が上昇する可能性がある。 | クラリスロマイシン及びコビシスタットのCYP3A阻害作用によるため。 |
| イトラコナゾール ボリコナゾール |
エルビテグラビル,コビシスタット及びこれら薬剤の血中濃度が上昇する可能性がある。 | これら薬剤及びコビシスタットのCYP3A等阻害作用によるため。 |
| フレカイニド酢酸塩 メキシレチン塩酸塩 |
これら薬剤の血中濃度が上昇する可能性がある。本剤と併用する場合は,これら薬剤の血中濃度をモニタリングすることが望ましい。 | コビシスタットのCYP2D6阻害作用によるため。 |
| ペルフェナジン | これら薬剤の血中濃度が上昇する可能性がある。これら薬剤と併用する場合は,患者の状態を注意して観察し,減量等の措置を考慮すること。 | コビシスタットのCYP2D6阻害作用によるため。 |
|
これら薬剤の血中濃度が上昇する可能性がある。これら薬剤と併用する場合は,患者の状態を注意して観察し,減量等の措置を考慮すること。 | コビシスタットのCYP2D6阻害作用によるため。 |
| リスペリドン | リスペリドンの血中濃度が上昇する可能性がある。本剤と併用する場合は,リスペリドンの減量を考慮すること。 | コビシスタットのCYP3A及びCYP2D6阻害作用によるため。 |
| 酒石酸トルテロジン デキストロメトルファン臭化水素酸塩水和物 |
これら薬剤の血中濃度が上昇する可能性がある。 | コビシスタットのCYP3A及びCYP2D6阻害作用によるため。 |
多価陽イオン(Mg,Al,Ca,Fe,Zn等)含有経口製剤
|
エルビテグラビルの血中濃度が低下する可能性があるため,2時間以上間隔をあけて投与することが望ましい。 | エルビテグラビルが多価陽イオンと錯体(キレート)を形成し吸収が抑制されるため。 |
| ジゴキシン [16.7.2 参照] |
ジゴキシンの血中濃度が上昇する可能性がある。本剤と併用する場合は,血中濃度のモニタリングを行うことが望ましい。 | コビシスタットが消化管においてP-gpを阻害するため。 |
| リファブチン [16.7.2 参照] |
エルビテグラビル及びコビシスタットの血中濃度が著しく低下し,テノホビル アラフェナミドの血中濃度が低下する可能性がある。また,リファブチンの活性代謝物である25-脱アセチル体の血中濃度が上昇する可能性がある。 | リファブチンのCYP3A及びP-gp誘導作用,及びコビシスタットのCYP3A阻害作用によるため。 |
| アシクロビル バラシクロビル塩酸塩 ガンシクロビル バルガンシクロビル塩酸塩 |
これら薬剤,テノホビル又はエムトリシタビンの血中濃度が上昇し,これら薬剤又は本剤による有害事象を増強する可能性がある。 | 尿細管への能動輸送により排泄される薬剤と併用する場合,排泄経路の競合により排泄が遅延するため。 |
| エチニルエストラジオール [16.7.2 参照] |
エチニルエストラジオールの血中濃度が低下する可能性がある。 | 機序不明。 |
| ワルファリンカリウム | ワルファリンの血中濃度が変動する可能性があるためINRのモニタリングを行うことが望ましい。 | 機序不明。 |
| 腎毒性を有する薬剤 [7.4 参照],[8.3 参照],[9.2.2 参照],[11.1.1 参照],[15.1 参照],[16.6.1 参照] |
併用は避けることが望ましい。 | 腎毒性を有する薬剤は腎機能障害の危険因子となる。 |
11. 副作用
次の副作用が現れることがあるので,観察を十分に行い,異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1 重大な副作用
11.1.1 腎不全又は重度の腎機能障害(1%未満)
腎機能不全,腎不全,急性腎障害,近位腎尿細管機能障害,ファンコニー症候群,急性腎尿細管壊死,腎性尿崩症又は腎炎等の重度の腎機能障害が現れることがあるので,臨床検査値に異常が認められた場合には,投与を中止する等,適切な処置を行うこと。特に腎機能障害の既往がある患者や腎毒性のある薬剤が投与されている患者では注意すること。[7.4 参照],[8.3 参照],[9.2.2 参照],[10.2 参照],[15.1 参照],[16.6.1 参照]
11.1.2 乳酸アシドーシス及び脂肪沈着による重度の肝腫大(脂肪肝)(頻度不明)
乳酸アシドーシス又は肝細胞毒性が疑われる臨床症状又は検査値異常(アミノトランスフェラーゼの急激な上昇等)が認められた場合には,本剤の投与を一時中止すること。特に肝疾患の危険因子を有する患者においては注意すること。エムトリシタビン又はテノホビルを含む核酸系逆転写酵素阻害薬の単独投与又はこれらの併用療法により,重篤な乳酸アシドーシス及び脂肪沈着による重度の肝腫大(脂肪肝)が,女性に多く報告されている。
11.2 その他の副作用
| 2%以上 | 2%未満 | 頻度不明 | |
|---|---|---|---|
| 代謝及び栄養障害 | 食欲減退 | 体脂肪の再分布/蓄積 | |
| 精神障害 | 不眠症,異常な夢 | ||
| 神経系障害 | 頭痛,浮動性めまい | 傾眠 | |
| 胃腸障害 | 悪心,下痢,放屁 | 腹部膨満,嘔吐,腹痛,上腹部痛,便秘,消化不良 | |
| 皮膚及び皮下組織障害 | 発疹 | 血管性浮腫,蕁麻疹 | |
| 筋骨格系及び結合組織障害 | 骨減少症,骨粗鬆症 | ||
| 腎及び尿路障害 | 蛋白尿 | ||
| 一般・全身障害及び投与部位の状態 | 疲労 |
13. 過量投与
13.1 処置
エムトリシタビン及びテノホビルは血液透析により一部除去される。エルビテグラビル及びコビシスタットは血漿蛋白との結合率が高いため,血液透析又は腹膜透析による除去は有用ではないと考えられる。
14. 適用上の注意
14.1 薬剤調製時の注意
粉砕時の安定性データは得られていないため,本剤を粉砕して使用しないこと。
15. その他の注意
15.1 臨床使用に基づく情報
健康被験者あるいは軽度から中等度の腎機能障害を有する被験者の腎機能(GFR)に及ぼすコビシスタットの影響を検討した。イオヘキソールクリアランスは変化がなかったが,血清クレアチニン値を用いた推算クレアチニンクリアランス及び24時間内因性クレアチニンクリアランスはプラセボに比べ最大で約28%低下した。なお,健康被験者で腎血漿流量を測定したところ,変化はなかった。[7.4 参照],[8.3 参照],[9.2.2 参照],[10.2 参照],[11.1.1 参照],[16.6.1 参照]
16. 薬物動態
16.1 血中濃度
16.1.1
日本人健康成人男性に本剤を食直後に単回経口投与した時の,エルビテグラビル,コビシスタット,エムトリシタビン,テノホビル アラフェナミド及びテノホビルの薬物動態パラメータを表1に示す13)。
| エルビテグラビル | コビシスタット | エムトリシタビン | テノホビル アラフェナミド | テノホビル | |
|---|---|---|---|---|---|
| tmax (hr) |
4.0 (3.0-5.0) |
2.5 (2.0-5.0) |
2.0 (1.0-4.0) |
1.0 (0.3-2.0) |
2.0 (1.0-3.0) |
| Cmax (μg/mL) |
2.5±0.4 | 1.1±0.3 | 2.8±0.7 | 0.16±0.08 | 0.01±0.00 |
| t1/2 (hr) |
6.0±1.3 | 3.2±0.8 | 13.1±3.1 | 0.42±0.06 | 42.5±4.2 |
| AUCinf (μg・hr/mL) |
32.3±7.9 | 6.9±2.9 | 14.2±2.8 | 0.15±0.03 | 0.29±0.05 |
平均値±標準偏差,12例(テノホビル アラフェナミドt1/2のみ3例),tmax:中央値(最小値-最大値)
16.1.2
外国人HIV-1感染症患者に本剤を食後に反復経口投与した時の,エルビテグラビル,コビシスタット,エムトリシタビン,テノホビル アラフェナミド及びテノホビルの薬物動態パラメータを表2に示す14)。
| エルビテグラビル | コビシスタット | エムトリシタビン | テノホビルアラフェナミド | テノホビル | |
|---|---|---|---|---|---|
| tmax (hr) |
3.9 (1.5-12.0) |
3.0 (1.5-5.0) |
1.5 (0.5-4.0) |
1.0 (0.3-3.0) |
3.0 (0.8-8.0) |
| Cmax (μg/mL) |
2.1±0.7 | 1.5±0.4 | 2.1±0.4 | 0.23±0.15 | 0.02±0.00 |
| t1/2 (hr) |
6.9±1.2 | 3.2±0.7 | 6.5±0.9 | 0.6±0.3 | 48.1±31.2 |
| AUCtau (μg・hr/mL) |
22.8±7.9 | 9.5±3.2 | 11.7±1.9 | 0.23±0.11 | 0.33±0.05 |
| Ctrough (μg/mL) |
0.29±0.18 | 0.02±0.02 | 0.10±0.04 | NC | 0.01±0.00 |
平均値±標準偏差,19例,tmax:中央値(最小値-最大値),NC:未算出
16.1.3
12歳以上18歳未満で体重35kg以上(コホート1),及び6歳以上12歳未満で体重25kg以上(コホート2)の外国人小児HIV-1感染症患者を対象とした非盲検試験において,本剤含有成分の薬物動態を検討した。本剤投与時の小児患者におけるエルビテグラビル,コビシスタット,エムトリシタビン,テノホビル アラフェナミド及びテノホビルの薬物動態パラメータを表3に示す15)。[9.7 参照]
| コホート | 例数 | エルビテグラビル | 例数 | コビシスタット | 例数 | エムトリシタビン | 例数 | テノホビルアラフェナミド | 例数 | テノホビル | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| tmax (hr) |
1 | 24 | 4.0 (1.0-8.0) |
24 | 4.0 (1.1-8.0) |
24 | 2.0 (0.5-5.0) |
24 | 1.5 (0.3-5.0) |
24 | 3.0 (0.3-5.0) |
| 2 | 23 | 4.1 (0.3-8.0) |
23 | 4.0 (1.5-8.0) |
23 | 1.6 (1.0-5.0) |
23 | 1.5 (0.3-4.0) |
23 | 2.0 (0.3-5.0) |
|
| Cmax (μg/mL) |
1 | 24 | 2.2±0.4 | 24 | 1.2±0.4 | 24 | 2.3±0.5 | 24 | 0.17±0.11 | 24 | 0.02±0.00 |
| 2 | 23 | 3.1±1.2 | 23 | 2.1±1.0 | 23 | 3.4±0.9 | 23 | 0.31±0.19 | 23 | 0.03±0.01 | |
| t1/2 (hr) |
1 | 24 | 6.6±2.6 | 23 | 2.9±0.8 | 24 | 5.4±0.9 | 23 | 0.6±0.3 | 23 | 72.2±117.5 |
| 2 | 14 | 5.2±1.6 | 15 | 2.8±0.5 | 21 | 4.8±0.5 | 11 | 0.6±0.3 | 22 | 39.7±17.2 | |
| AUCtau (μg・hr/mL) |
1 | 24 | 23.8±6.1 | 23 | 8.2±3.0 | 24 | 14.4±3.5 | 24 | 0.19±0.11 | 23 | 0.29±0.05 |
| 2 | 22 | 33.8±19.5 | 20 | 15.9±8.2 | 22 | 20.6±3.9 | 23 | 0.33±0.15 | 23 | 0.44±0.09 |
平均値±標準偏差,tmax:中央値(最小値-最大値), テノホビル アラフェナミドのみAUClast
コホート1:12歳以上18歳未満で体重35kg以上, コホート2:6歳以上12歳未満で体重25kg以上
16.2 吸収
16.2.1 食事の影響
日本人健康成人男性に対して本剤を空腹時に投与した場合,普通食(413kcal)摂取時と比較して,エルビテグラビルのCmax及びAUCinfは,それぞれ57%及び50%低下し,コビシスタット,エムトリシタビン,テノホビル アラフェナミド及びテノホビルのCmax及びAUCinfはいずれも同程度であった。一方,軽食(250kcal,32%が脂肪由来)摂取時と普通食摂取時に投与した場合の比較では,いずれの成分もCmax及びAUCinfは同程度であった13)。
16.3 分布
エルビテグラビル:ヒト血漿蛋白に対する結合率は1ng/mL~1.6μg/mLの濃度範囲において濃度に依存せず98~99%であった。エルビテグラビルの血液中濃度/血漿中濃度比は0.73であった(外国人における成績)16)。
コビシスタット:ヒト血漿蛋白に対する結合率は97~98%であり17),血液中濃度/血漿中濃度比は0.5であった(外国人における成績)4)。
エムトリシタビン:ヒト血漿蛋白に対する結合率は,0.02~200μg/mLの濃度範囲において濃度に依存せず4%未満であった(外国人における成績)。
テノホビル アラフェナミド:テノホビル アラフェナミドのヒト血漿蛋白に対する結合率は77~86%であった(外国人における成績)18)。
テノホビル:テノホビルのヒト血漿蛋白に対する結合率は0.7%未満であった(外国人における成績)19)。
16.4 代謝
エルビテグラビル:肝ミクロソーム及びCYPアイソザイムを用いたin vitro試験において,エルビテグラビルは主にCYP3Aにより代謝され,また,UGT1A1/3により,グルクロン酸抱合を受けた(外国人における成績)3)。
コビシスタット:肝ミクロソーム及びCYPアイソザイムを用いたin vitro試験において,コビシスタットは主にCYP3Aにより代謝され,一部CYP2D6で代謝された4)。また,in vivo試料中に,グルクロン酸抱合体は検出されなかった(外国人における成績)20)。
エムトリシタビン:ヒト肝ミクロソームを用いた各種検討において,2%未満の代謝物が検出された。14C-エムトリシタビンを単回投与したところ,投与量の13%の代謝物がヒト尿中に検出された(外国人における成績)21),22)。
テノホビル アラフェナミド:経口投与後,末梢血単核球及びマクロファージのカテプシンA及び肝細胞のカルボキシルエステラーゼ1によりテノホビルに代謝され,その後,テノホビル二リン酸に代謝された9),10),23)。CYP分子種発現系酵素を用いた検討において,テノホビル アラフェナミドはCYP3Aでわずかに代謝され,その代謝速度は1.9pmol/min/pmol CYPであった(外国人における成績)11)。
16.5 排泄
エルビテグラビル:健康被験者にリトナビル100mgでブーストして14C-エルビテグラビル50mgを単回投与したところ,投与量の94.8%が糞中に,6.7%が尿中に排泄された(外国人における成績)16)。
コビシスタット:健康被験者にコビシスタット150mgを6日間反復投与した後に14C-コビシスタット150mgを投与したところ,投与量の86.2%が糞中に,8.2%が尿中に排泄された(外国人における成績)20)。
エムトリシタビン:健康被験者にエムトリシタビン200mgを反復投与した後14C-エムトリシタビンを単回投与したところ,投与量の86%は尿中に,14%は糞中に排泄された22)。腎クリアランスが推定クレアチニンクリアランスを上回ったことから,糸球体ろ過と尿細管への能動輸送の両方による排泄が示唆された(外国人における成績)7)。
テノホビル アラフェナミド:健康被験者に14C-テノホビル アラフェナミドフマル酸塩を単回投与したところ,投与量の47.2%が糞中に,36.2%が尿中に排泄された。その主成分はテノホビルであり,糞中の99%,尿中の86%を占めた。また,投与量の1.4%がテノホビル アラフェナミドとして尿中に排泄された24)。テノホビルは腎臓での糸球体ろ過と尿細管への能動輸送の両方により排泄された(外国人における成績)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
エルビテグラビル及びコビシスタット:クレアチニンクリアランスが15mL/min以上30mL/min未満の重度の腎機能障害を有する被験者(非透析患者)における,エルビテグラビル150mg及びコビシスタット150mg投与時のエルビテグラビル及びコビシスタットのAUCは,クレアチニンクリアランスが90mL/min超の被験者に対し,それぞれ約25%低下及び約25%上昇した(外国人における成績)25)。[7.4 参照],[8.3 参照],[10.2 参照],[11.1.1 参照],[15.1 参照]
エムトリシタビン:クレアチニンクリアランスが30mL/min未満の重度の腎機能障害を有する被験者における,エムトリシタビン200mg単回投与時のエムトリシタビンのCmax及びAUCは,クレアチニンクリアランスが80mL/min超の被験者に対し,それぞれ約30%及び約200%上昇した(外国人における成績)26)。[7.4 参照],[8.3 参照],[9.2.2 参照],[10.2 参照],[11.1.1 参照]
テノホビル アラフェナミド:クレアチニンクリアランスが15mL/min以上30mL/min未満の重度の腎機能障害を有する被験者(非透析患者)における,テノホビル アラフェナミド25mg単回投与時のテノホビル アラフェナミドのCmax及びAUCは,クレアチニンクリアランスが90mL/min超の被験者に対し,それぞれ79%及び92%上昇し,テノホビルのCmax及びAUCは,それぞれ179%及び474%上昇した(外国人における成績)27)。[7.4 参照],[8.3 参照],[10.2 参照],[11.1.1 参照]
16.6.2 肝機能障害患者
エルビテグラビル及びコビシスタット:中等度の肝機能障害(Child-Pugh分類クラスB)を有する被験者における,エルビテグラビル150mg及びコビシスタット150mg投与時のエルビテグラビル及びコビシスタットのAUCは,肝機能正常被験者に対し,エルビテグラビルでは35%上昇したが,コビシスタットでは変化は認められなかった(外国人における成績)28)。[9.3.2 参照]
エムトリシタビン:肝機能障害を有する被験者における薬物動態は検討していない。
テノホビル アラフェナミド:軽度の肝機能障害(Child-Pugh分類クラスA)を有する被験者における,テノホビル アラフェナミド25mg単回投与時のテノホビル アラフェナミドのCmax及びAUCは,肝機能正常被験者に対し,それぞれ11%及び8%低下し,テノホビルのCmax及びAUCは,それぞれ3%及び11%低下した。また,中等度の肝機能障害(Child-Pugh分類クラスB)を有する被験者における,テノホビル アラフェナミド25mg単回投与時のテノホビル アラフェナミドのCmax及びAUCは,肝機能正常被験者に対し,それぞれ19%及び13%上昇し,テノホビルのCmax及びAUCは,それぞれ12%及び3%低下した(外国人における成績)29)。
16.6.3 妊娠中のHIV-1感染症患者
妊娠中のHIV-1感染症患者における,エルビテグラビル150mg及びコビシスタット150mgを含むレジメン投与時のエルビテグラビル及びコビシスタットの薬物動態を検討した。その結果,出産後(6~12週)に対し妊娠中期(14例)では,エルビテグラビルのCmax,AUC0-24hr及びCminがそれぞれ8%,24%及び82%低下し,コビシスタットのCmax,AUC0-24hr及びCminがそれぞれ28%,44%及び61%低下した。また,出産後に対し妊娠後期(24例)では,エルビテグラビルのCmax,AUC0-24hr及びCminがそれぞれ28%,44%及び86%低下し,コビシスタットのCmax,AUC0-24hr及びCminがそれぞれ38%,59%及び67%低下した30)。[9.5 参照]
16.7 薬物相互作用
16.7.1 非臨床における薬物相互作用試験
エルビテグラビル:CYP3Aに対する弱い阻害作用を示し,CYP3A及びCYP2C9に対する誘導作用も認められた31),32)。
また,P-gp,BCRP,OATP1B1及びOATP1B3の基質であり,P-gp,BCRP,OATP1B3及びMATE1に対する阻害作用が認められた33),34)。[10. 参照]
コビシスタット:CYP3Aに対する強い阻害作用が認められた35)。CYP2B6,CYP2C8,CYP2D6及びUGT1A1に対しても弱い阻害作用を示し,CYP3Aに対する弱い誘導作用も認められた36)。また,P-gp,BCRP,OATP1B1,OATP1B3及びOCT2の基質であり,P-gp,BCRP,BSEP,OATP1B1,OATP1B3,MATE1,MATE2-K,OCT1,OCT2,OCTN1,MRP1,MRP2及びMRP4に対する阻害作用を示した5),33),37)。[10. 参照]
エムトリシタビン:OAT3の基質である38)。[10. 参照]
テノホビル アラフェナミド:P-gp,BCRP,OATP1B1及びOATP1B3の基質である12),39)。また,テノホビルは,OAT1,OAT3及びMRP4の基質であり,OAT1に対する弱い阻害作用(IC50値:29.3μM)を示した40),41)。[10. 参照]
16.7.2 臨床における薬物相互作用試験
健康成人に対し,本剤又は本剤の有効成分を含有する製剤と併用薬を投与した時の,本剤の有効成分又は併用薬の薬物動態への影響を表4~9に示す。
| 併用薬 | 併用薬の用量・ |
エルビテグラビル |
コビシスタット又は |
例数 | 他剤併用時/非併用時のエルビテグラビルの 薬物動態パラメータ比(90%信頼区間) |
||
|---|---|---|---|---|---|---|---|
| Cmax | AUC | Cmin | |||||
| マグネシウム・アルミニウム含有制酸剤42) [10.2 参照] |
20mL 4hr前 単回 |
50mg 単回 |
リトナビル 100mg 単回 |
8 | 0.95 (0.84, 1.07) |
0.96 (0.88, 1.04) |
1.04 (0.93, 1.17) |
| 20mL 4hr後 単回 |
10 | 0.98 (0.88, 1.10) |
0.98 (0.91, 1.06) |
1.00 (0.90, 1.11) |
|||
| 20mL 2hr前 単回 |
11 | 0.82 (0.74, 0.91) |
0.85 (0.79, 0.91) |
0.90 (0.82, 0.99) |
|||
| 20mL 2hr後 単回 |
10 | 0.79 (0.71, 0.88) |
0.80 (0.75, 0.86) |
0.80 (0.73, 0.89) |
|||
| アトルバスタチン43) [10.2 参照] |
10mg 単回 |
150mg 1日1回注2) |
コビシスタット 150mg 1日1回注2) |
16 | 0.91 (0.85, 0.98) |
0.92 (0.87, 0.98) |
0.88 (0.81, 0.96) |
| ファモチジン42) | 40mg 12hr後 1日1回 |
150mg 1日1回 |
コビシスタット 150mg 1日1回 |
10 | 1.02 (0.89, 1.17) |
1.03 (0.95, 1.13) |
1.18 (1.05, 1.32) |
| 40mg 同時 1日1回 |
16 | 1.00 (0.92, 1.10) |
1.03 (0.98, 1.08) |
1.07 (0.98, 1.17) |
|||
| ケトコナゾール44) | 200mg 1日2回 |
150mg 1日1回 |
リトナビル 100mg 1日1回 |
18 | 1.17 (1.04, 1.33) |
1.48 (1.36, 1.62) |
1.67 (1.48, 1.88) |
| レジパスビル・ソホスブビル45) | 90/400mg 1日1回 |
150mg 1日1回注2) |
コビシスタット 150mg 1日1回注2) |
30 | 0.98 (0.90, 1.07) |
1.11 (1.02, 1.20) |
1.46 (1.28, 1.66) |
| オメプラゾール42) | 40mg 2hr前 1日1回 |
50mg 1日1回 |
リトナビル 100mg 1日1回 |
9 | 0.93 (0.83, 1.04) |
0.99 (0.91, 1.07) |
0.94 (0.85, 1.04) |
| 20mg 2hr前 1日1回 |
150mg 1日1回 |
コビシスタット 150mg 1日1回 |
11 | 1.16 (1.04, 1.30) |
1.10 (1.02, 1.19) |
1.13 (0.96, 1.34) |
|
| 20mg 12hr後 1日1回 |
11 | 1.03 (0.92, 1.15) |
1.05 (0.93, 1.18) |
1.10 (0.92, 1.32) |
|||
| リファブチン46) [10.2 参照] |
150mg 隔日1回 |
150mg 1日1回 |
コビシスタット 150mg 1日1回 |
12 | 0.91 (0.84, 0.99) |
0.79 (0.74, 0.85) |
0.33 (0.27, 0.40) |
| ロスバスタチン47) | 10mg 単回 |
150mg 1日1回 |
コビシスタット 150mg 1日1回 |
10 | 0.94 (0.83, 1.07) |
1.02 (0.91, 1.14) |
0.98 (0.83, 1.16) |
| セルトラリン48) | 50mg 単回 |
150mg 1日1回注2) |
コビシスタット 150mg 1日1回注2) |
19 | 0.88 (0.82, 0.93) |
0.94 (0.89, 0.98) |
0.99 (0.93, 1.05) |
| ソホスブビル・ベルパタスビル49) | 400/100mg 1日1回 |
150mg 1日1回注2) |
コビシスタット 150mg 1日1回注2) |
24 | 0.87 (0.80, 0.94) |
0.94 (0.88, 1.00) |
1.08 (0.97, 1.20) |
| ソホスブビル・ベルパタスビル ・Voxilaprevir(国内未承認)50) |
400/100/100mg +Voxilaprevir 100mg 1日1回 |
150mg 1日1回注2) |
コビシスタット 150mg 1日1回注2) |
29 | 0.79 (0.75, 0.85) |
0.94 (0.88, 1.00) |
1.32 (1.17, 1.49) |
- 注1) エルビテグラビル製剤投与からの時間(hr:時間)
- 注2) 本剤を用いた薬物動態試験
| 併用薬 | 併用薬の用量・ |
エルビテグラビル |
コビシスタット |
例数 | 他剤併用時/非併用時のコビシスタットの 薬物動態パラメータ比(90%信頼区間) |
||
|---|---|---|---|---|---|---|---|
| Cmax | AUC | Cmin | |||||
| アトルバスタチン43) [10.2 参照] |
10mg 単回 |
150mg 1日1回注4) |
150mg 1日1回注4) |
16 | 1.03 (0.98, 1.07) |
1.00 (0.96, 1.04) |
1.10 (0.98, 1.23) |
| ファモチジン42) | 40mg 12hr後 1日1回 |
150mg 1日1回 |
150mg 1日1回 |
10 | 1.04 (0.99, 1.08) |
1.05 (1.02, 1.08) |
1.15 (1.06, 1.26) |
| 40mg 同時 1日1回 |
16 | 1.06 (0.99, 1.13) |
1.03 (0.97, 1.11) |
1.11 (1.00, 1.24) |
|||
| ソホスブビル・ベルパタスビル49) | 400/100mg 1日1回 |
150mg 1日1回注4) |
150mg 1日1回注4) |
24 | 1.16 (1.09, 1.23) |
1.30 (1.23, 1.38) |
2.03 (1.67, 2.48) |
| ソホスブビル・ベルパタスビル ・Voxilaprevir(国内未承認)50) |
400/100/100mg +Voxilaprevir 100mg 1日1回 |
150mg 1日1回注4) |
150mg 1日1回注4) |
29 | 1.23 (1.18, 1.28) |
1.50 (1.44, 1.58) |
3.50 (3.01, 4.07) |
| レジパスビル・ソホスブビル45) | 90/400mg 1日1回 |
150mg 1日1回注4) |
150mg 1日1回注4) |
30 | 1.23 (1.15, 1.32) |
1.53 (1.45, 1.62) |
3.25 (2.88, 3.67) |
| オメプラゾール42) | 20mg 2hr前 1日1回 |
150mg 1日1回 |
150mg 1日1回 |
11 | 0.90 (0.82, 0.99) |
0.92 (0.85, 1.01) |
0.93 (0.74, 1.17) |
| 20mg 12hr後 1日1回 |
11 | 0.94 (0.85, 1.05) |
0.99 (0.89, 1.09) |
1.02 (0.82, 1.28)注5) |
|||
| ダルナビル51) | 800mg 1日1回 |
NA注6) | 150mg 1日1回注6) |
14 | 1.06 (1.00, 1.12) |
1.09 (1.03, 1.15) |
1.11 (0.98, 1.25) |
NA:投与せず
- 注3)コビシスタット製剤投与からの時間(hr:時間)
- 注4)本剤を用いた薬物動態試験
- 注5)Cminのみ10例
- 注6)ダルナビル・コビシスタットとエムトリシタビン・テノホビル アラフェナミドフマル酸塩を用いた薬物動態試験
| 併用薬 | 併用薬の用量・ |
エムトリシタビン |
例数 | 他剤併用時/非併用時のエムトリシタビンの 薬物動態パラメータ比(90%信頼区間) |
||
|---|---|---|---|---|---|---|
| Cmax | AUC | Cmin | ||||
| ダルナビル51) | 800mg+コビシスタット 150mg 1日1回 |
200mg 1日1回注7) |
11 | 1.13 (1.02, 1.24) |
1.24 (1.17, 1.31) |
1.31 (1.24, 1.38) |
| エファビレンツ51) | 600mg 1日1回 空腹時 |
200mg 1日1回 |
11 | 0.90 (0.81, 0.99) |
0.92 (0.87, 0.96) |
0.92 (0.86, 0.98) |
| セルトラリン48) | 50mg 単回 |
200mg 1日1回注8) |
19 | 0.90 (0.82, 0.98) |
0.84 (0.81, 0.88) |
0.94 (0.90, 0.99) |
| ソホスブビル・ベルパタスビル49) | 400/100mg 1日1回 |
200mg 1日1回注8) |
24 | 1.02 (0.97, 1.06) |
1.01 (0.98, 1.04) |
1.02 (0.97, 1.07) |
| ソホスブビル・ベルパタスビル ・Voxilaprevir(国内未承認)50) |
400/100/100mg +Voxilaprevir 100mg 1日1回 |
200mg 1日1回注8) |
29 | 0.87 (0.84, 0.91) |
0.96 (0.94, 0.99) |
1.14 (1.09, 1.20) |
| タクロリムス52) [10.2 参照] |
0.05mg/kg 1日2回 |
200mg 1日1回注9) |
21 | 0.89 (0.83, 0.95) |
0.95 (0.91, 0.99) |
1.03 (0.96, 1.10) |
| ファムシクロビル53) | 500mg 単回 |
200mg 単回 |
12 | 0.90 (0.80, 1.01) |
0.93 (0.87, 0.99) |
NC |
| レジパスビル・ソホスブビル45) | 90/400mg 1日1回 |
200mg 1日1回注8) |
30 | 1.03 (0.96, 1.11) |
0.97 (0.93, 1.00) |
0.95 (0.91, 0.99) |
NC:未算出
- 注7) ダルナビル・コビシスタットとエムトリシタビン・テノホビル アラフェナミドフマル酸塩を用いた薬物動態試験
- 注8) 本剤を用いた薬物動態試験
- 注9) エムトリシタビン・テノホビル ジソプロキシルフマル酸塩を用いた薬物動態試験
| 併用薬 | 併用薬の用量・ |
テノホビル アラフェナミド |
例数 | 他剤併用時/非併用時のテノホビル アラフェナミドの 薬物動態パラメータ比(90%信頼区間) |
||
|---|---|---|---|---|---|---|
| Cmax | AUC | Cmin | ||||
| アトルバスタチン43) [10.2 参照] |
10mg 単回 |
10mg 1日1回注10) |
16 | 0.97 (0.73, 1.28) |
1.00 (0.84, 1.19) |
NC |
| コビシスタット51) | 150mg 1日1回 |
8mg 1日1回注11) |
12 | 2.83 (2.20, 3.65) |
2.65 (2.29, 3.07) |
NC |
| レジパスビル・ソホスブビル45) | 90/400mg 1日1回 |
10mg 1日1回注10) |
30 | 0.90 (0.73, 1.11) |
0.86 (0.78, 0.95) |
NC |
| セルトラリン48) | 50mg 単回 |
10mg 1日1回注10) |
19 | 1.00 (0.86, 1.16) |
0.96 (0.89, 1.03) |
NC |
| エファビレンツ51) | 600mg 1日1回 空腹時 |
40mg 1日1回注12) |
11 | 0.78 (0.58, 1.05) |
0.86 (0.72, 1.02) |
NC |
| ダルナビル・コビシスタット51) | 800/150mg 1日1回 |
25mg 1日1回注12) |
11 | 0.93 (0.72, 1.21) |
0.98 (0.80, 1.19) |
NC |
| ソホスブビル・ベルパタスビル49) | 400/100mg 1日1回 |
10mg 1日1回注10) |
24 | 0.80 (0.68, 0.94) |
0.87 (0.81, 0.94) |
NC |
| ソホスブビル・ベルパタスビル ・Voxilaprevir(国内未承認)50) |
400/100/100mg +Voxilaprevir 100mg 1日1回 |
10mg 1日1回注10) |
29 | 0.79 (0.68, 0.92) |
0.93 (0.85, 1.01) |
NC |
NC:未算出
- 注10) 本剤を用いた薬物動態試験
- 注11) テノホビル アラフェナミドフマル酸塩を用いた薬物動態試験
- 注12) エムトリシタビン・テノホビル アラフェナミドフマル酸塩を用いた薬物動態試験
| 併用薬 | 併用薬の用量・ |
テノホビル |
例数 | 他剤併用時/非併用時のテノホビルの 薬物動態パラメータ比(90%信頼区間) |
||
|---|---|---|---|---|---|---|
| Cmax | AUC | Cmin | ||||
| アトルバスタチン43) [10.2 参照] |
10mg 単回 |
テノホビル アラフェナミド10mg 1日1回注13) |
16 | 0.96 (0.89, 1.04) |
0.99 (0.97, 1.01) |
1.01 (0.99, 1.04) |
| コビシスタット51) | 150mg 1日1回 |
テノホビル アラフェナミド8mg 1日1回注14) |
12 | 3.34 (3.02, 3.70) |
3.31 (3.10, 3.53) |
3.35 (3.12, 3.59) |
| セルトラリン48) | 50mg 単回 |
テノホビル アラフェナミド10mg 1日1回注13) |
19 | 1.10 (1.00, 1.21) |
1.02 (1.00, 1.04) |
1.01 (0.99, 1.03) |
| エファビレンツ51) | 600mg 1日1回 空腹時 |
テノホビル アラフェナミド40mg 1日1回注15) |
11 | 0.75 (0.67, 0.86) |
0.80 (0.73, 0.87) |
0.82 (0.75, 0.89) |
| ダルナビル・コビシスタット51) | 800/150mg 1日1回 |
テノホビル アラフェナミド25mg 1日1回注15) |
11 | 3.16 (3.00, 3.33) |
3.24 (3.02, 3.47) |
3.21 (2.90, 3.54) |
| ソホスブビル・ベルパタスビル49) | 400/100mg 1日1回 |
テノホビル アラフェナミド10mg 1日1回注13) |
24 | 1.20 (1.16, 1.24) |
1.22 (1.18, 1.25) |
1.23 (1.19, 1.28) |
| ソホスブビル・ベルパタスビル ・Voxilaprevir(国内未承認)50) |
400/100/100mg +Voxilaprevir 100mg 1日1回 |
テノホビル アラフェナミド10mg 1日1回注13) |
29 | 1.09 (1.05, 1.13) |
1.20 (1.17, 1.23) |
1.21 (1.18, 1.26) |
| レジパスビル・ソホスブビル45) | 90/400mg 1日1回 |
テノホビル アラフェナミド10mg 1日1回注13) |
30 | 1.17 (1.12, 1.22) |
1.27 (1.23, 1.31) |
1.33 (1.28, 1.38) |
- 注13) 本剤を用いた薬物動態試験
- 注14) テノホビル アラフェナミドフマル酸塩を用いた薬物動態試験
- 注15) エムトリシタビン・テノホビル アラフェナミドフマル酸塩を用いた薬物動態試験
| 併用薬 | 併用薬の用量 | エルビテグラビル |
コビシスタット |
テノホビル アラフェナミド |
例数 | 他剤併用時/非併用時の併用薬の 薬物動態パラメータ比(90%信頼区間) |
||
|---|---|---|---|---|---|---|---|---|
| Cmax | AUC | Cmin | ||||||
| アトルバスタチン43) [10.2 参照] |
10mg 単回 |
150mg 1日1回注17) |
150mg 1日1回注17) |
10mg 1日1回注17) |
16 | 2.32 (1.91, 2.82) |
2.60 (2.31, 2.93) |
NC |
| ブプレノルフィン54) | 16~24mg 1日1回 |
150mg 1日1回 |
150mg 1日1回 |
NA | 17 | 1.12 (0.98, 1.27) |
1.35 (1.18, 1.55) |
1.66 (1.43, 1.93) |
| ノルブプレノルフィン54) | 1.24 (1.03, 1.49) |
1.42 (1.22, 1.67) |
1.57 (1.31, 1.88) |
|||||
| デシプラミン (国内未承認)55) |
50mg 単回 |
NA | 150mg 1日1回 |
NA | 8 | 1.24 (1.08, 1.44) |
1.65 (1.36, 2.02) |
NC |
| ジゴキシン55) [10.2 参照] |
0.5mg 単回 |
NA | 150mg 1日1回 |
NA | 22 | 1.41 (1.29, 1.55) |
1.08 (1.00, 1.17) |
NC |
| レジパスビル45) | 90mg 1日1回 |
150mg 1日1回注17) |
150mg 1日1回注17) |
10mg 1日1回注17) |
30 | 1.65 (1.53, 1.78) |
1.79 (1.64, 1.96) |
1.93 (1.74, 2.15) |
| ソホスブビル45) | 400mg 1日1回 |
1.28 (1.13, 1.47) |
1.47 (1.35, 1.59) |
NC | ||||
| ソホスブビル主要代謝物45) | 1.29 (1.24, 1.35) |
1.48 (1.44, 1.53) |
1.66 (1.60, 1.73) |
|||||
| ナロキソン54) | 4~6mg 1日1回 |
150mg 1日1回 |
150mg 1日1回 |
NA | 17 | 0.72 (0.61, 0.85) |
0.72 (0.59, 0.87) |
NC |
| ノレルゲストロミン56) | ノルゲスチメート 0.180/0.215/0.250mg ・エチニルエストラジオール 0.025mg 1日1回 |
150mg 1日1回注18) |
150mg 1日1回注18) |
NA | 13 | 2.08 (2.00, 2.17) |
2.26 (2.15, 2.37) |
2.67 (2.43, 2.92) |
| エチニルエストラジオール56) [10.2 参照] |
0.94 (0.86, 1.04) |
0.75 (0.69, 0.81) |
0.56 (0.52, 0.61) |
|||||
| ノレルゲストロミン57) | ノルゲスチメート 0.180/0.215/0.250mg ・エチニルエストラジオール 0.025mg 1日1回 |
NA | NA | 25mg 1日1回注19) |
15 | 1.17 (1.07, 1.26) |
1.12 (1.07, 1.17) |
1.16 (1.08, 1.24) |
| ノルゲストレル57) | 1.10 (1.02, 1.18) |
1.09 (1.01, 1.18) |
1.11 (1.03, 1.20) |
|||||
| エチニルエストラジオール57) [10.2 参照] |
1.22 (1.15, 1.29) |
1.11 (1.07, 1.16) |
1.02 (0.92, 1.12) |
|||||
| R-メサドン58) | 80~120mg 1日1回 |
150mg 1日1回 |
150mg 1日1回 |
NA | 11 | 1.01 (0.91, 1.13) |
1.07 (0.96, 1.19) |
1.10 (0.95, 1.28) |
| S-メサドン58) | 0.96 (0.87, 1.06) |
1.00 (0.89, 1.12) |
1.02 (0.89, 1.17) |
|||||
| セルトラリン48) | 50mg 単回 |
150mg 1日1回注17) |
150mg 1日1回注17) |
10mg 1日1回注17) |
20 | 1.14 (0.94, 1.38) |
1.09 (0.90, 1.32) |
NC |
| リファブチン46) [10.2 参照] |
150mg 隔日1回 |
150mg 1日1回 |
150mg 1日1回 |
NA | 12 | 1.09 (0.98, 1.20)注20) |
0.92 (0.83, 1.03)注20) |
0.94 (0.85, 1.04)注20) |
| 25-脱アセチル体代謝物46) | 4.84 (4.09, 5.74)注20) |
6.25 (5.08, 7.69)注20) |
4.94 (4.04, 6.04)注20) |
|||||
| ロスバスタチン47) | 10mg 単回 |
150mg 1日1回 |
150mg 1日1回 |
NA | 10 | 1.89 (1.48, 2.42) |
1.38 (1.14, 1.67) |
NC |
| ダルナビル51) | 800mg 1日1回 |
NA注21) | 150mg 1日1回注21) |
25mg 1日1回注21) |
14 | 1.02 (0.96, 1.09) |
0.99 (0.92, 1.07) |
0.97 (0.82, 1.15) |
| ベルパタスビル49) | 100mg 1日1回 |
150mg 1日1回注17) |
150mg 1日1回注17) |
10mg 1日1回注17) |
24 | 1.30 (1.17, 1.45) |
1.50 (1.35, 1.66) |
1.60 (1.44, 1.78) |
| ソホスブビル49) | 400mg 1日1回 |
1.23 (1.07, 1.42) |
1.37 (1.24, 1.52) |
NC | ||||
| ソホスブビル主要代謝物49) | 1.29 (1.25, 1.33) |
1.48 (1.43, 1.53) |
1.58 (1.52, 1.65) |
|||||
| ベルパタスビル50) | 100mg 1日1回 |
150mg 1日1回注17) |
150mg 1日1回注17) |
10mg 1日1回注17) |
29 | 0.96 (0.89, 1.04) |
1.16 (1.06, 1.27) |
1.46 (1.30, 1.64) |
| Voxilaprevir (国内未承認)50) |
100mg+100mg 1日1回 |
1.92 (1.63, 2.26) |
2.71 (2.30, 3.19) |
4.50 (3.68, 5.50) |
||||
| ソホスブビル50) | 400mg 1日1回 |
1.27 (1.09, 1.48) |
1.22 (1.12, 1.32) |
NC | ||||
| ソホスブビル主要代謝物50) | 1.28 (1.25, 1.32) |
1.43 (1.39, 1.47) |
NC | |||||
NA:投与せず,NC:未算出
- 注16) エルビテグラビル,コビシスタット,エムトリシタビン及びテノホビル ジソプロキシルフマル酸塩を含有する抗HIV薬
- 注17) 本剤を用いた薬物動態試験
- 注18) スタリビルド配合錠を用いた薬物動態試験
- 注19) エムトリシタビン・テノホビル アラフェナミドフマル酸塩を用いた薬物動態試験
- 注20) リファブチン300mg 1日1回投与時との比較
- 注21) ダルナビル・コビシスタットとエムトリシタビン・テノホビル アラフェナミドフマル酸塩を用いた薬物動態試験
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 海外第III相試験(292-0104試験)
抗HIV薬による治療経験がないHIV-1感染症患者を対象とし,スタリビルド配合錠(エルビテグラビルとして150mg,コビシスタットとして150mg,エムトリシタビンとして200mg及びテノホビル ジソプロキシルフマル酸塩として300mgを含有する抗HIV薬)を対照とした無作為化二重盲検並行比較試験の結果を表1に示す(投与後48週時及び96週時)59)。なお,国内において組み入れられた被験者10例(本剤投与群4例,スタリビルド配合錠投与群6例)における投与後48週時のHIV-1 RNA量が50copies/mL未満の被験者の割合は,本剤投与群及びスタリビルド配合錠投与群ともに100%であった。
| 本剤投与群 (435例) |
スタリビルド (432例) |
|
|---|---|---|
| 48週時 | ||
| ウイルス学的効果 HIV-1 RNA量 50copies/mL未満 |
405 (93.1%) |
401 (92.8%) |
| 群間差 (95.002%信頼区間) |
0.5% (-3.0%, 4.0%) |
|
| ウイルス学的失敗例注1) | 13 (3.0%) |
11 (2.5%) |
| 96週時 | ||
| ウイルス学的効果 HIV-1 RNA量 50copies/mL未満 |
388 (89.2%) |
381 (88.2%) |
| 群間差 (95%信頼区間) |
1.3% (-2.9%, 5.5%) |
|
| ウイルス学的失敗例注1) | 16 (3.7%) |
11 (2.5%) |
例数(%)
注1) 投与後48週又は96週時の血漿中HIV-1 RNA量が50copies/mL以上の症例,治療効果の欠如及び減弱により早期に中止した症例,有害事象,死亡,治療効果の欠如又は減弱以外の理由で中止した症例のうち,中止時の血漿中HIV-1 RNA量が50copies/mL以上であった症例
副作用発現頻度は,本剤投与群で44.8%(195/435例)であった。主な副作用は,悪心11.0%(48/435例),下痢8.7%(38/435例),頭痛6.4%(28/435例)であった。
17.1.2 海外第III相試験(292-0111試験)
抗HIV薬による治療経験がないHIV-1感染症患者を対象とし,スタリビルド配合錠を対照とした無作為化二重盲検並行比較試験の結果を表2に示す(投与後48週時及び96週時)59)。
| 本剤投与群 (431例) |
スタリビルド (435例) |
|
|---|---|---|
| 48週時 | ||
| ウイルス学的効果 HIV-1 RNA量 50copies/mL未満 |
396 (91.9%) |
386 (88.7%) |
| 群間差 (95.002%信頼区間) |
3.1% (-0.9%, 7.1%) |
|
| ウイルス学的失敗例注2) | 18 (4.2%) |
23 (5.3%) |
| 96週時 | ||
| ウイルス学的効果 HIV-1 RNA量 50copies/mL未満 |
362 (84.0%) |
358 (82.3%) |
| 群間差 (95%信頼区間) |
1.7% (-3.3%, 6.8%) |
|
| ウイルス学的失敗例注2) | 23 (5.3%) |
24 (5.5%) |
例数(%)
注2) 投与後48週又は96週時の血漿中HIV-1 RNA量が50copies/mL以上の症例,治療効果の欠如及び減弱により早期に中止した症例,有害事象,死亡,治療効果の欠如又は減弱以外の理由で中止した症例のうち,中止時の血漿中HIV-1 RNA量が50copies/mL以上であった症例
副作用発現頻度は,本剤投与群で39.9%(172/431例)であった。主な副作用は,悪心9.7%(42/431例),下痢5.8%(25/431例),頭痛5.8%(25/431例),疲労4.4%(19/431例)であった。
17.1.3 海外第III相試験(292-0109試験)
抗HIV薬による治療経験があり,ウイルス学的に抑制されているHIV-1感染症患者を対象とし,エムトリシタビン・テノホビル ジソプロキシルフマル酸塩を含むレジメンから本剤に切り替えた際の,本剤の有効性及び安全性を検討するために実施した,エムトリシタビン・テノホビル ジソプロキシルフマル酸塩を含むレジメン継続投与を対照とした無作為化非盲検並行比較試験の結果を表3に示す(投与後48週時)60)。
| 本剤投与群 (959例) |
エムトリシタビン・ テノホビルジソプロキシルフマル酸塩を 含むレジメンの継続投与群 (477例) |
|
|---|---|---|
| ウイルス学的効果 HIV-1 RNA量 50copies/mL未満 |
932 (97.2%) |
444 (93.1%) |
| 群間差 (95%信頼区間) |
4.1% (1.6%, 6.7%) |
|
| ウイルス学的失敗例注3) | 10 (1.0%) |
6 (1.3%) |
例数(%)
注3) 投与後48週時の血漿中HIV-1 RNA量が50copies/mL以上の症例,治療効果の欠如及び減弱により早期に中止した症例,有害事象,死亡,治療効果の欠如又は減弱以外の理由で中止した症例のうち,中止時の血漿中HIV-1 RNA量が50copies/mL以上であった症例
副作用発現頻度は,本剤投与群で21.3%(204/959例)であった。主な副作用は,下痢2.5%(24/959例),悪心2.3%(22/959例)であった。
18. 薬効薬理
18.1 作用機序
エルビテグラビル:エルビテグラビルは,HIV-1インテグラーゼの阻害薬である。インテグラーゼの阻害により,HIV-DNAの宿主DNAへの組み込みを抑え,HIV-1プロウイルスの形成及びウイルス増殖を阻止する。エルビテグラビルは,ヒトトポイソメラーゼI及びIIのいずれも阻害しない61)。
コビシスタット:コビシスタットは,CYP3Aの選択的な阻害薬である4)。
エムトリシタビン:エムトリシタビンは,シチジンの合成ヌクレオシド誘導体であり,細胞内酵素によりリン酸化されエムトリシタビン5’-三リン酸となる62)。エムトリシタビン5’-三リン酸はHIV-1逆転写酵素の基質であるデオキシシチジン5’-三リン酸と競合すること及び新生ウイルスDNAに取り込まれた後にDNA鎖伸長を停止させることにより,HIV-1逆転写酵素の活性を阻害する。哺乳類のDNAポリメラーゼα,β,ε及びミトコンドリアDNAポリメラーゼγに対するエムトリシタビン5’-三リン酸の阻害作用は弱い63)。
テノホビル アラフェナミド:テノホビル アラフェナミドは,テノホビルのホスホンアミド酸プロドラッグ(2’-デオキシアデノシン一リン酸誘導体)である。テノホビル アラフェナミドは,血漿中の安定性が高く,細胞内透過性を有し,末梢血単核球及びマクロファージ中のカテプシンAにより加水分解を受けて細胞内にテノホビルを送達する。その後,細胞内酵素によってリン酸化を受け,テノホビル二リン酸となる64)。テノホビル二リン酸は,HIV-1逆転写酵素の基質であるデオキシアデノシン5’-三リン酸と競合すること及びDNAに取り込まれた後にDNA鎖伸長を停止させることにより,HIV-1逆転写酵素の活性を阻害する。哺乳類のDNAポリメラーゼα,β及びミトコンドリアDNAポリメラーゼγに対するテノホビル二リン酸の阻害作用は弱い65)。
18.2 抗ウイルス作用(in vitro)
エルビテグラビル,エムトリシタビン及びテノホビル アラフェナミドを細胞培養系で評価した結果,相乗的な抗ウイルス活性が認められた。また,コビシスタットを加えてもエルビテグラビル,エムトリシタビン及びテノホビル アラフェナミドの抗ウイルス活性は維持された。
エルビテグラビル:ヒトTリンパ芽球様細胞,単球/マクロファージ及び末梢血リンパ球初代培養細胞を用いて,HIV-1の実験室株及び臨床分離株に対するエルビテグラビルの抗ウイルス活性を評価した。エルビテグラビルの50%阻害濃度(EC50値)は0.02~1.7nMの範囲であった66)。
コビシスタット:コビシスタットは,HIV-1,HBV及びHCVに対する抗ウイルス活性を有さず,また,エルビテグラビル,エムトリシタビンあるいはテノホビルの抗ウイルス活性に対する拮抗作用は認められなかった67)。
エムトリシタビン:ヒトTリンパ芽球様細胞株,MAGI-CCR5細胞株及び末梢血単核球初代培養細胞を用いて,HIV-1の実験室株及び臨床分離株に対するエムトリシタビンの抗ウイルス活性を評価した。エムトリシタビンのEC50値は,0.0013~0.64μMの範囲であった68),69)。
テノホビル アラフェナミド:ヒトTリンパ芽球様細胞株,単球/マクロファージ及び末梢血リンパ球初代培養細胞を用いて,HIV-1の実験室株及び臨床分離株に対するテノホビル アラフェナミドの抗ウイルス活性を評価した。テノホビル アラフェナミドのEC50値は,0.1~15.7nMの範囲であった70)。
18.3 薬剤耐性
18.3.1 in vitro試験
エルビテグラビル:in vitro試験で誘導されたエルビテグラビルに対する感受性が低下したHIV-1分離株には,インテグラーゼのT66A/I,E92G/Q,S147G及びQ148Rが主要変異として認められた。また,主要変異が認められたHIV-1分離株には,D10E,S17N,H51Y,F121Y,S153F/Y,E157Q,D232N,R263K及びV281Mも認められた。
エムトリシタビン:エムトリシタビンに対する感受性低下は,HIV-1逆転写酵素のM184V/I変異と関連が認められた71)。
テノホビル アラフェナミド:テノホビル アラフェナミドに対する感受性が低下したHIV-1分離株では,K65R変異が発現しており,K70E変異も一過性に認められた72)。
18.3.2 臨床試験
(1) 抗HIV薬による治療経験がないHIV-1感染症患者
292-0104試験及び292-0111試験において,ウイルス学的失敗と判定された被験者のうち,投与96週後又は早期に試験中止となった時点の血漿中HIV-1 RNA量が400copies/mLを超えた被験者から分離したHIV-1を解析し,19例(2.2%,19/866例)の遺伝子型及び表現型解析結果が得られた。遺伝子型解析結果から,エルビテグラビル,エムトリシタビン又はテノホビルの主要耐性関連変異が一つ以上認められたのは,10例(1.2%,10/866例)であった。認められた変異は,逆転写酵素領域のM184V/I(9例),K65R/N(2例)及びK70R(1例),インテグラーゼ領域のT66A/I/V(2例),E92Q(4例),Q148R(1例)及びN155H/S(2例)であった。また,表現型解析結果から,エルビテグラビルに対する感受性が野生株に対して10.9倍から101倍低下したHIV-1分離株が7例(0.8%,7/866例)に,エムトリシタビンに対する感受性が野生株に対して28倍から117倍超低下したHIV-1分離株が8例(0.9%,8/866例)に,テノホビルに対する感受性が野生株に対して3倍低下したHIV-1分離株が1例(0.1%,1/866例)に認められた。
(2) 抗HIV薬による治療経験があり,ウイルス学的に抑制されているHIV-1感染症患者
292-0109試験において,投与48週時点で遺伝子型及び表現型解析の対象となった被験者に耐性変異は認められなかった。
18.4 交差耐性
エルビテグラビル耐性のHIV-1分離株はエムトリシタビン又はテノホビルに対して交差耐性を示さず,エムトリシタビン又はテノホビル耐性のHIV-1分離株はエルビテグラビルに対して交差耐性を示さなかった73)。
エルビテグラビル:エルビテグラビル耐性ウイルスは,変異の種類及び数に応じて,インテグラーゼ阻害薬であるラルテグラビルに対して様々な程度の交差耐性を示す。T66I/A変異を持つウイルスはラルテグラビルに対する感受性を維持しているが,その他のほとんどのエルビテグラビル耐性ウイルスはラルテグラビルに対する感受性が低下した。エルビテグラビル又はラルテグラビル耐性変異を持つウイルスはドルテグラビルに対する感受性を維持した74),75)。
エムトリシタビン:核酸系逆転写酵素阻害薬の間で交差耐性が認められた。エムトリシタビン耐性のM184V/I変異を有するHIV-1株は,ラミブジンに対して交差耐性を示した。また,アバカビル,ジダノシン及びテノホビルの投与によりin vivoで出現したK65R変異を有するHIV-1株では,エムトリシタビンに対する感受性の低下が確認された72),76)。
テノホビル アラフェナミド:K65R及びK70E変異を持つHIV-1株は,アバカビル,ジダノシン,ラミブジン,エムトリシタビン及びテノホビルに対する感受性の低下を示すが,ジドブジンに対する感受性を維持する。T69S二重挿入変異又はK65Rを含むQ151M複合変異を持ち,核酸系逆転写酵素阻害薬に多剤耐性を示すHIV-1は,テノホビルに対する感受性の低下を示した77),78),79)。
19. 有効成分に関する理化学的知見
| 一般的名称 | エルビテグラビル(Elvitegravir) |
|---|---|
| 化学名 | 6-[(3-Chloro-2-fluorophenyl)methyl]-1-[(2S)-1-hydroxy-3-methylbutan-2-yl]-7-methoxy-4-oxo-1,4-dihydroquinoline-3-carboxylic acid |
| 分子式 | C23H23ClFNO5 |
| 分子量 | 447.88 |
| 性状 | 白色~微黄色の粉末であり,ジメチルスルホキシド,N, N-ジメチルホルムアミド又はテトラヒドロフランに溶けやすく,アセトニトリル,メタノール又はエタノール(95)にやや溶けにくく,2-プロパノールに溶けにくく,水にほとんど溶けない。 |
| 化学構造式 | 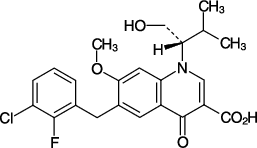 |
| 融点 | 約163℃ |
| 分配係数 | LogD=4.5(pH6.8) |
| 一般的名称 | コビシスタット(Cobicistat) |
|---|---|
| 化学名 | 1,3-Thiazol-5-ylmethyl{(2R,5R)-5-[(2S)-2-(3-methyl-3-{[2-(1-methylethyl)-1,3-thiazol-4-yl]methyl}ureido)-4-(morpholin-4-yl)butanamido]-1,6-diphenylhexan-2-yl}carbamate |
| 分子式 | C40H53N7O5S2 |
| 分子量 | 776.02 |
| 性状 | 白色~微黄色の固体であり,アセトニトリル,ジクロロメタン,ジメチルスルホキシド又はメタノールに溶けやすく,水又はヘプタンにほとんど溶けない。 |
| 化学構造式 | 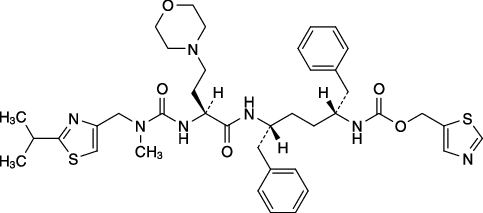 |
| 融点 | ガラス転移温度35℃,約200℃(分解) |
| 分配係数 | 4.3(1-オクタノール/pH8.5のリン酸塩緩衝液) |
| 一般的名称 | エムトリシタビン(Emtricitabine) |
| 化学名 | 4-Amino-5-fluoro-1-[(2R,5S)-2-(hydroxymethyl)-1,3-oxathiolan-5-yl]pyrimidin-2(1H)-one |
| 分子式 | C8H10FN3O3S |
| 分子量 | 247.25 |
| 性状 | 白色~帯黄白色の粉末であり,水,メタノールに溶けやすく,アセトニトリルに溶けにくく,酢酸イソプロピルに極めて溶けにくい。 |
| 化学構造式 | 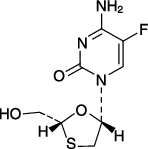 |
| 融点 | 約155℃ |
| 分配係数 | -0.43(オクタノール/水) |
| 一般的名称 | テノホビル アラフェナミドフマル酸塩(Tenofovir Alafenamide Fumarate) |
|---|---|
| 化学名 | 1-Methylethyl N-[(S)-{[(1R)-2-(6-amino-9H-purin-9-yl)-1-methylethoxy]methyl}phenoxyphosphinoyl]-L-alaninate hemifumarate |
| 分子式 | (C21H29N6O5P)2・C4H4O4 |
| 分子量 | 1069.00 |
| 性状 | 白色~灰白色又は白色~くすんだ黄赤色の粉末であり,メタノールに溶けやすく,エタノール(99.5)にやや溶けやすく,水又は2-プロパノールにやや溶けにくく,アセトン又はアセトニトリルに溶けにくく,トルエンに極めて溶けにくい。 |
| 化学構造式 | 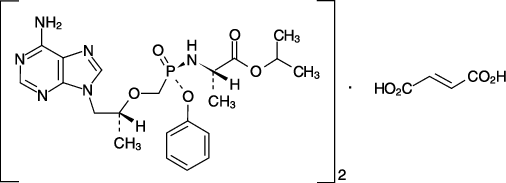 |
| 融点 | 約132℃ |
| 分配係数 | 1.6(1-オクタノール/pH7のリン酸塩緩衝液) |
20. 取扱い上の注意
開栓後は,湿気を避けて保存すること。
21. 承認条件
21.1
医薬品リスク管理計画を策定の上,適切に実施すること。
21.2
本剤の使用に当たっては,患者に対して本剤に関して更なる有効性・安全性のデータを引き続き収集中であること等を十分に説明し,インフォームドコンセントを得るよう,医師に要請すること。
21.3
現在実施中又は計画中の臨床試験については,終了後速やかに試験成績及び解析結果を提出すること。
21.4
再審査期間が終了するまでの間,原則として国内の全投与症例を対象とした製造販売後調査を実施し,本剤の使用実態に関する情報(患者背景,有効性・安全性(他剤併用時の有効性・安全性を含む)及び薬物相互作用のデータ等)を収集して定期的に報告するとともに,調査の結果を再審査申請時に提出すること。
22. 包装
30錠/瓶[乾燥剤入り]
23. 主要文献
- 社内資料:1278-005試験(VAD承認年月日:2004.3.25)[GEN-011]
- Benaboud S. et al. Antimicrob. Agents Chemother. 2011;55(3):1315-1317.[GEN-012]
- Ramanathan S. et al. Clin Pharmacokinet. 2011;50(4):229-244.[GEN-001]
- 社内資料:216-2025試験(STB承認年月日:2013.3.25, CTD 4.2.2.4, CTD 4.2.2.6, CTD 5.3.2.2)[GEN-002]
- 社内資料:216-2112試験[GEN-003]
- 社内資料:216-2072試験(STB承認年月日:2013.3.25, CTD 4.2.2.6, CTD 5.3.2.3)[GEN-004]
- 社内資料:FTC-101試験(EMT承認年月日:2005.3.23)[GEN-005]
- 社内資料:901/701試験(VAD承認年月日:2004.3.25)[GEN-006]
- Birkus G. et al. Antimicrob. Agents Chemother. 2007;51(2):543-550.[GEN-007]
- Birkus G. et al. Mol Pharmacol. 2008;74(1):92-100.[GEN-008]
- 社内資料:120-2004試験(GEN承認年月日:2016.6.17, CTD 4.2.2.6, CTD 5.3.2.2)[GEN-009]
- 社内資料:120-2018試験(GEN承認年月日:2016.6.17, CTD 4.2.2.6, CTD 5.3.2.2)[GEN-010]
- 社内資料:SBX5-1試験(GEN承認年月日:2016.6.17, CTD 5.3.3.1)[GEN-013]
- Paul E. S. et al. J. Acquir. Immune. Defic. Syndr. 2014;67(1):52-58.[GEN-014]
- 社内資料:292-0106試験(GEN承認年月日:2016.6.17, CTD 5.3.5.2,GEN承認年月日:2019.5.22, CTD 5.3.5.2)[GEN-024]
- 社内資料:183-0126試験(STB承認年月日:2013.3.25, CTD 5.3.3.1)[GEN-015]
- 社内資料:216-2026試験(STB承認年月日:2013.3.25, CTD 4.2.2.3, CTD 5.3.2.1)[GEN-016]
- 社内資料:120-0108/0114試験(GEN承認年月日:2016.6.17, CTD 5.3.3.3)[GEN-017]
- 社内資料:P504-00039.1試験[GEN-018]
- 社内資料:216-0111試験(STB承認年月日:2013.3.25, CTD 5.3.3.1)[GEN-019]
- 社内資料:15396試験(EMT承認年月日:2005.3.23)[GEN-020]
- 社内資料:FTC-106試験(EMT承認年月日:2005.3.23)[GEN-021]
- 社内資料:120-2031試験(GEN承認年月日:2016.6.17, CTD 4.2.2.6, CTD 5.3.2.2)[GEN-022]
- 社内資料:120-0109試験(GEN承認年月日:2016.6.17, CTD 5.3.3.1)[GEN-023]
- 社内資料:216-0124試験(STB承認年月日:2013.3.25, CTD 5.3.3.3)[GEN-025]
- 社内資料:FTC-107試験(EMT承認年月日:2005.3.23)[GEN-026]
- 社内資料:120-0108試験(GEN承認年月日:2016.6.17, CTD 5.3.3.3)[GEN-027]
- Joseph M. C. et al. Antimicrob. Agents Chemother. 2014;58(5):2564-2569.[GEN-028]
- 社内資料:120-0114試験(GEN承認年月日:2016.6.17, CTD 5.3.3.3)[GEN-029]
- Jeremiah D. M. et al.:AIDS. 2018;32(17):2507-2516.[GEN-079]
- 社内資料:JTK303-027試験(STB承認年月日:2013.3.25, CTD 4.2.2.6, CTD 5.3.2.2)[GEN-030]
- 社内資料:JTK303-023試験(STB承認年月日:2013.3.25, CTD 4.2.2.6, CTD 5.3.2.2)[GEN-031]
- 社内資料:236-2001/2002/2003/2004/2005試験(STB承認年月日:2013.3.25, CTD 4.2.2.6)[GEN-032]
- 社内資料:183-2030試験(STB承認年月日:2013.3.25, CTD 4.2.2.6, CTD 5.3.2.3)[GEN-033]
- 社内資料:216-2028試験(STB承認年月日:2013.3.25, CTD 4.2.1.1, CTD 4.2.2.6, CTD 5.3.2.2)[GEN-034]
- 社内資料:216-2029/2070/2071/2075試験(STB承認年月日:2013.3.25, CTD 4.2.2.6, CTD 5.3.2.2)[GEN-035]
- 社内資料:216-2030/2094/2098/2100/2105_236-2008試験(STB承認年月日:2013.3.25, CTD 4.2.2.6, CTD 5.3.2.3(216-2030/2094/2098/2100/2105), CTD 4.2.2.6(236-2008))[GEN-036]
- 社内資料:236-2010試験(STB承認年月日:2013.3.25, CTD 4.2.2.6)[GEN-037]
- 社内資料:120-2022試験(GEN承認年月日:2016.6.17, CTD 4.2.2.6, CTD 5.3.2.2)[GEN-038]
- Adrian S. R. et al. Antimicrob. Agents Chemother. 2006;50(10):3297-3304.[GEN-039]
- Mandíková J. et al. Toxicology. 2013;311(3):135-146.[GEN-040]
- Ramanathan S. et al. J. Acquir. Immune. Defic. Syndr. 2013;64(1):45-50.[GEN-041]
- 社内資料:216-1008試験[GEN-042]
- 社内資料:183-0146試験(STB承認年月日:2013.3.25, CTD 5.3.3.4)[GEN-043]
- 社内資料:337-1624試験[GEN-044]
- 社内資料:216-0123試験(STB承認年月日:2013.3.25, CTD 5.3.3.4)[GEN-045]
- Joseph M. C. et al. J Clin Pharmacol. 2014;54(6):649-656.[GEN-046]
- 社内資料:292-1316試験(GEN承認年月日:2016.6.17, CTD 5.3.3.4)[GEN-047]
- 社内資料:342-1167試験[GEN-048]
- 社内資料:367-1657試験[GEN-049]
- 社内資料:311-0101試験(GEN承認年月日:2016.6.17, CTD 5.3.3.4)[GEN-050]
- 社内資料:174-0105試験[GEN-051]
- 社内資料:FTC-108試験(EMT承認年月日:2005.3.23)[GEN-052]
- Robert D. B. et al. J. Acquir. Immune. Defic. Syndr. 2013;63(4):480-484.[GEN-053]
- 社内資料:216-0112試験(STB承認年月日:2013.3.25, CTD 5.3.4.1)[GEN-054]
- 社内資料:311-1790試験[GEN-055]
- 社内資料:236-0106試験(STB承認年月日:2013.3.25, CTD 5.3.3.4)[GEN-056]
- Robert D. B. et al. Antimicrob. Agents Chemother. 2013;57(12):6154-6157.[GEN-057]
- Wohl D. et al. J. Acquir. Immune. Defic. Syndr. 2016;72(1):58-64.[GEN-058]
- Mills A. et al. Lancet Infect Dis. 2016;16(1):43-52.[GEN-059]
- 社内資料:303-001/002/004試験(STB承認年月日:2013.3.25, CTD 5.3.5.4(303-001/002), CTD 4.2.1.2(303-004))[GEN-060]
- Paff M. T. et al. Antimicrob. Agents Chemother. 1994;38(6):1230-1238.[GEN-061]
- George R. P. et al. Drugs Future. 1995;20(8):761-765.[GEN-062]
- Robbins B. L. et al. Antimicrob. Agents Chemother. 1998;42(3):612-617.[GEN-063]
- Cihlar T. et al. Antivir. Chem. Chemother. 1997;8(3):187-195.[GEN-064]
- 社内資料:303-010試験(STB承認年月日:2013.3.25, CTD 5.3.5.4)[GEN-065]
- 社内資料:216-2001試験(STB承認年月日:2013.3.25, CTD 5.3.5.4)[GEN-066]
- Jeong L. S. et al. J. Med. Chem. 1993;36(2):181-195.[GEN-067]
- Schinazi R. F. et al. Antimicrob. Agents Chemother. 1992;36(11):2423-2431.[GEN-068]
- 社内資料:120-2003/2004/2007/2017試験(GEN承認年月日:2016.6.17, CTD 4.2.1.1, CTD 5.3.5.4)[GEN-069]
- Tisdale M. et al. Proc. Natl. Acad. Sci. USA. 1993;90(12):5653-5656.[GEN-070]
- 社内資料:120-2011試験(GEN承認年月日:2016.6.17, CTD 4.2.1.1, CTD 5.3.5.4)[GEN-071]
- 社内資料:120-2020試験(GEN承認年月日:2016.6.17, CTD 5.3.5.4)[GEN-072]
- 社内資料:183-2025試験(STB承認年月日:2013.3.25, CTD 5.3.5.4)[GEN-073]
- Kobayashi M. et al. Antimicrob. Agents Chemother. 2011;55(2):813-821.[GEN-074]
- Schinazi R. F. et al. Antimicrob. Agents Chemother. 1993;37(4):875-881.[GEN-075]
- 社内資料:15883試験(GEN承認年月日:2016.6.17, CTD 4.2.1.1)[GEN-076]
- Kagan R. M. et al. Antiviral Res. 2007;75(3):210-218.[GEN-077]
- 社内資料:120-2014試験(GEN承認年月日:2016.6.17, CTD 4.2.1.1, CTD 5.3.5.4)[GEN-078]
24. 文献請求先及び問い合わせ先
ギリアド・サイエンシズ株式会社
メディカルサポートセンター
〒100-6616 東京都千代田区丸の内一丁目9番2号
グラントウキョウサウスタワー
フリーダイアル 0120-506-295
FAX 03-5958-2959
受付時間:9:00~17:30(土・日・祝日及び会社休日を除く)
26. 製造販売業者等
26.1 製造販売元
ギリアド・サイエンシズ株式会社
東京都千代田区丸の内1-9-2
グラントウキョウサウスタワー